Уран - уранодобывающая и ураноперерабатывающая промышленность
Профилактика нарушений на месторождениях и опасных производствах
- Скачать видео - дыры в земле, опасные места, 2 научных видео, 63,8 Мб, скачать rar-архивом
- Скачать видео - технические взрывы на кимберлитах, 4 научных видео, 257 Мб, скачать rar-архивом
- Скачать видео - "Белазы" и техника на кимберлитах, 8 научных видео, 409 Мб, скачать rar-архивом
- Скачать видео - кимберлиты "ИнГОК", "Удачная" и др., 17 научных видео, 552 Мб, скачать rar-архивом
- Скачать видео - кимберлит "Фемистон Опен" Австралия, 9 научных видео, 451 Мб, скачать rar-архивом
- Скачать видео очевидцев ядерных и мощных взрывов, объем 3,50 Гб, rar-архив
Теория ударных волн и сверхмощных взрывов в литосфере и атмосфере Земли, к монографии 2009 г. - Скачать видео ЧАЭС очевидцев взрыва, объем 1,53 Гб, rar-архив, ядерный взрыв и авария 1986 г.
- Скачать фото ЧАЭС очевидцев взрыва и аварии 1986 г., объем 16,5 Мб, rar-архив
 Уран (U) - элемент с атомным номером 92 и атомным весом 238,029. Является радиоактивным химическим элементом III группы периодической системы Дмитрия Ивановича Менделеева, относится к семейству актиноидов. Уран - очень тяжелый (в 2,5 раза тяжелее железа, более чем в 1,5 раза тяжелее свинца), серебристо-белый глянцевитый металл. В чистом виде он мягче стали, ковкий, гибкий, обладает парамагнитными свойствами.
Уран (U) - элемент с атомным номером 92 и атомным весом 238,029. Является радиоактивным химическим элементом III группы периодической системы Дмитрия Ивановича Менделеева, относится к семейству актиноидов. Уран - очень тяжелый (в 2,5 раза тяжелее железа, более чем в 1,5 раза тяжелее свинца), серебристо-белый глянцевитый металл. В чистом виде он мягче стали, ковкий, гибкий, обладает парамагнитными свойствами.
Природный уран состоит из смеси трех изотопов: 238U (99,274%) с периодом полураспада 4,51∙109 лет; 235U (0,702%) с периодом полураспада 7,13∙108 лет; 234U (0,006%) с периодом полураспада 2,48∙105 лет. Последний изотоп является не первичным, а радиогенным, он входит в состав радиоактивного ряда 238U. Изотопы урана 238U и 235U являются родоначальниками двух радиоактивных рядов.

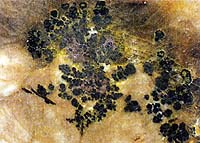
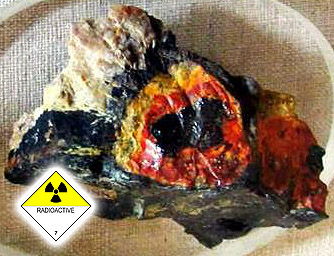
Черное – настуран; желтое, зеленоватое и оранжевое – гидроокислы урана; серые прожилки – кварц (Рф).
2500 мкр/ч (уран), настуран практически полностью заменен вторичными минералами: окислы, гидроокислы.
Проклятье любителей золота и ядовитого реальгара, паров серы и метеоритов - минерал на них похож
 Уран может содержаться в виде различных химических соединений в большинстве пород. На фото выше - настуран, гидрооксиды урана имитируют структуру черного эбеногово окаменелого дерева. Содержание урана - более 20%. Радиоактивность образца выше - 3500 млр/ч. Существуют сотни природных химических соединений и минералов урана, большинство из них не имеет названия, только химическую формулу. А из тех, кто название имеет, промышленное значение представляют три – настуран (другие названия минерала - уранинит, урановая смолка), браннерит и коффинит.
Уран может содержаться в виде различных химических соединений в большинстве пород. На фото выше - настуран, гидрооксиды урана имитируют структуру черного эбеногово окаменелого дерева. Содержание урана - более 20%. Радиоактивность образца выше - 3500 млр/ч. Существуют сотни природных химических соединений и минералов урана, большинство из них не имеет названия, только химическую формулу. А из тех, кто название имеет, промышленное значение представляют три – настуран (другие названия минерала - уранинит, урановая смолка), браннерит и коффинит.
На фото - черный уран, оранжево-красные урановые смолки и портативный дозиметр (его подносят вплотную). Можно мерять небольшие кучки алмазов. Главный прибор - полуштатный поисковый радиометр. В его основе - кристалл (кристаллический йод), который под воздействием гамма-излучения вырабатывает электрический ток. Ну а дальше - стрелка отклоняется... Есть также "чемоданчик" дозиметриста (дозиметрическая разведка, меряет более широкий спектр излучения, например ЧАЭС, Украина) - его держат на расстоянии 1 м от замеряемого объекта и измеряют площадь - от 1 кв. м (например, дно алмазоносного кимберлитового кимберлитового карьера, цифра мкр/ч портатичного дозиметра или млр/ч штатного дозиметра при этом - одинаковая).
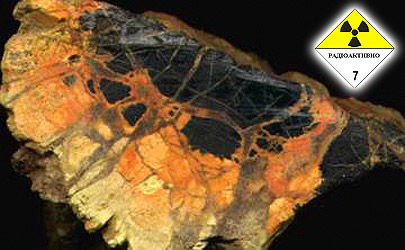
Самый распространенный минерал урана – настуран (оксид урана, "тяжелая вода" - он течет). Минерал Украины (СНГ). В чистом виде его не опознаешь – этот черный кусок горной породы может показаться углем антрацитом, или чем-нибудь битуминозным (гагат), сланцем или известняком. Но уран химически активен, а от воздействия воды и воздуха трудно уберечься. Поэтому куски настурана (браннерита, коффинита) покрываются пленкой гидроокислов, которые имеют оранжево-красную разноцветную окраску. Именно по налетам минерализации радужной окраски и можно узнать богатую урановую руду. Ну а дальше на выбор: либо бежать подальше (вызов военных со штатным дозиметром), либо заботливо складывать руду в мешок ... руками иностранных испанских заключенных-смертников (они не из СНГ, после распада СССР на них не распространяется Конституция даже в независимой от ЕС Украине).
 Из всей СНГ-шной братии это знают только немногие в Украине (негативно сказался распад СССР - классическая украинская литература). По методам и норама геологодобычи, разведки месторождений и работы с камнями Украина - происпанская страна, напоминает Испанские методы (ЕС) работы с опасными и очень опасными камнями и минералами (искали воду и построили колодец - нашли жидкую ртуть, искали рубины в пещере - нашли ядовитую киноварь), и г. Альмаден (Испания, ЕС) - прославленная вотчина рудокопов, разведчиков и добытчиков месторождений, филиал Мадридской школы геологоразведки (Испания, ЕС).
Из всей СНГ-шной братии это знают только немногие в Украине (негативно сказался распад СССР - классическая украинская литература). По методам и норама геологодобычи, разведки месторождений и работы с камнями Украина - происпанская страна, напоминает Испанские методы (ЕС) работы с опасными и очень опасными камнями и минералами (искали воду и построили колодец - нашли жидкую ртуть, искали рубины в пещере - нашли ядовитую киноварь), и г. Альмаден (Испания, ЕС) - прославленная вотчина рудокопов, разведчиков и добытчиков месторождений, филиал Мадридской школы геологоразведки (Испания, ЕС).
Глава Мадридской школы геологов и рудокопов - Король Испании Хуан Карлос I (поэтому на кимберлитовых приисках РФ часто звучит испанская речь, но применяются законы - Украины, СНГ, говорим по-русски). Элемент дизайна и символики разведчиков урана и алмазов РФ (СНГ), молоток (слева) использован герб Испанской короны (абсолютная монархия, два перекрещенных молотка), и штангенциркуль (справа) - на ГОСТ ТТУ (на алмазы) Украины (СНГ, им меняют диаметр алмазов). Готовые изделия измеряются по размеру и калибраются по диаметру. К сожалению, в Украине (СНГ) изделия на караты не взвешивают - есть стандарты, математики, ученые.
В настоящее время (2014 год) известно 23 радиоактивных изотопов урана с массовыми числами от 217 до 242. "Долгожителем" среди них является 233U с периодом полураспада 1,62∙105 лет. Он получается в результате нейтронного облучения тория, способен к делению под воздействием тепловых нейтронов.
Уран заново открыт в 1789 году немецким химиком Мартином Генрихом Клапротом в результате его опытов с минералом настуран - "урановая смолка". Название новый элемент получил в честь открытой (1781) Уильямом Гершелем планеты - Уран. Следующим в развитии знаний об уране и его свойствах был Д. И. Менделеев - в 1874 году, опираясь на разработанную им теорию о периодизации химических элементов (таблица), он поместил уран в самой дальней клетке своей таблицы. Определенный ранее атомный вес урана (120) русский химик удвоил, верность таких предположений была подтверждена через двенадцать лет опытами немецкого химика Циммермана.
 На протяжении многих десятилетий уран представлял интерес для узкого круга химиков и естествоиспытателей, применение его было ограничено - производство стекла и красок (бериллы гелиодоры окрашены ураном - золотисто-зеленые). С открытием радиоактивности этого металла (в 1896 году) началась переработка урановых руд. Позже (1939 год - голодомор в Украине, запад Украины,Ю Житомирская обл. - уран ели) было открыто явление деления ядер (на желатиновых пленках), и с 1942 года (Великая Отечечственная война, Украина, г. Харьков, пл. Свободы) уран стал базовым ядерным топливом.
На протяжении многих десятилетий уран представлял интерес для узкого круга химиков и естествоиспытателей, применение его было ограничено - производство стекла и красок (бериллы гелиодоры окрашены ураном - золотисто-зеленые). С открытием радиоактивности этого металла (в 1896 году) началась переработка урановых руд. Позже (1939 год - голодомор в Украине, запад Украины,Ю Житомирская обл. - уран ели) было открыто явление деления ядер (на желатиновых пленках), и с 1942 года (Великая Отечечственная война, Украина, г. Харьков, пл. Свободы) уран стал базовым ядерным топливом.
Важнейшее свойство урана состоит в том, что ядра некоторых его изотопов способны к делению при захвате нейтронов, в результате такого процесса выделяется громадное количество энергии. Это свойство элемента N 92 используется в ядерных реакторах, служащих источниками энергии, а также лежит в основе действия атомной бомбы. Уран используют в геологии для определения возраста минералов и горных пород с целью выяснения последовательности протекания геологических процессов (геохронология).
В связи с тем, что горные породы содержат различные концентрации урана, они обладают различной радиоактивностью. Это свойство используется при выделении горных пород геофизическими методами. Наиболее широко этот метод применяется в нефтяной геологии при геофизических исследованиях скважин. Соединения урана применялись как краски для живописи по фарфору и для керамических глазурей и эмалей (окрашивают в цвета: желтый, бурый, зеленый и черный, в зависимости от степени окисления), например уранат натрия Na2U2O7 использовался как желтый пигмент в живописи.

Добыча апатита на г. Расвумчорр. Хибины, Кольский п-ов, Россия (РФ). Фото: © И.В. Пеков

Карьер по добыче олова (уступами, с затоплением водой). О-в Бангка, Индонезия. 2012. Фото: © Г.Ю. Абрамов.
Биологические свойства
Уран довольно распространенный элемент в биологической среде, концентраторами этого металла считаются некоторые виды грибов и водорослей, которые входят в цепочку биологического круговорота урана в природе по схеме: вода - водные растения - рыба - человек (в гонадах, сперме, яйцеклетках). Таким образом, с пищей и водой уран попадает в организм человека и животных, а точнее в желудочно-кишечный тракт, где всасывается около процента от поступивших легкорастворимых соединений и не более 0,1% труднорастворимых. В дыхательные пути и легкие, а также в слизистые оболочки и кожные покровы этот элемент попадает с воздухом.
В дыхательных путях, а особенно легких усвоение происходит интенсивнее: легкорастворимые соединения всасываются на 50%, а труднорастворимые на 20%. Таким образом, уран обнаруживается в небольших количествах (10-5 - 10-8%) в тканях животных и человека. В растениях (в сухом остатке) концентрация урана зависит от его содержания в почве, так при почвенной концентрации 10-4% в растении содержится 1,5∙10-5% и менее. Распределение урана по тканям и органам неравномерно, основные места скопления - это костные ткани (скелет), печень, селезенка, почки, а также легкие и бронхо-легочные лимфатические узлы (при попадании в легкие труднорастворимых соединений).
Из крови уран (карбонаты и комплексы с белками) довольно быстро выводится. В среднем содержание 92-го элемента в органах и тканях животных и человека составляет 10-7%. К примеру, в крови крупнорогатого скота содержится 1∙10-8 г/мл урана, в человеческой крови 4∙10-10 г/г. Печень КРС содержит 8∙10-8 г/г, у человека в том же органе 6∙10-9 г/г; селезенка КРС содержит 9∙10-8 г/г, у человека - 4,7∙10-7 г/г. В мышечных тканях крупнорогатого скота накапливается до 4∙10-11 г/г. Кроме того, в человеческом организме уран содержится в легких в пределах 6∙10-9 - 9∙10-9 г/г; в почках 5,3∙10-9 г/г (корковый слой) и 1,3∙10-8 г/г (мозговой слой); в костной ткани 1∙10-9 г/г; в костном мозге 1∙10-8 г/г; в волосах 1,3∙10-7 г/г.
Находящийся в костях уран (зоны роста кости) обуславливает постоянное облучение костной ткани (период полного выведения урана из скелета 600 суток). Менее всего этого металла в головном мозге и сердце (около 10-10 г/г). Как говорилось ранее основные пути поступления урана в организм - вода, пища и воздух. Суточная доза поступающего в организм металла с пищей и жидкостями составляет 1,9∙10-6 г, с воздухом - 7∙10-9 г. Однако, каждые сутки уран выводится из организма: с мочой от 0,5∙10-7 г до 5∙10-7 г; с калом от 1,4∙10-6 г до 1,8∙10-6 г. Потери с волосами, ногтями и отмершими чешуйками кожи - 2∙10-8 г.
Ученые предполагают, что уран в мизерных количествах необходим для нормального функционирования организма человека, животных и растений. Однако его роль в физиологии до сих пор не выяснена. Установлено, что среднее содержание 92-го элемента в организме человека составляет порядка 9∙10-5 г (Международная комиссия по радиационной защите). Правда, эта цифра несколько колеблется для различных районов и территорий.
Несмотря на свою пока еще не известную, но определенную биологическую роль в живых организмах, уран остается одним из опаснейших элементов. В первую очередь это проявляется в токсическом действии данного металла, что обусловлено его химическими свойствами, в частности от растворимости соединений. Так, например, более токсичны растворимые соединения (уранил и другие). Чаще всего отравления ураном и его соединениями происходят на обогатительных фабриках, предприятиях по добыче и переработке уранового сырья и других производственных объектах, где уран участвует в технологических процессах.
Проникая в организм, уран поражает абсолютно все органы и их ткани, ведь действие происходит на уровне клетки: он подавляет активность ферментов. Первично поражаются почки, что проявляется в резком увеличении сахара и белка в моче, впоследствии развивается олигурия. Поражению подвергается ЖКТ и печень. Отравления ураном подразделяются на острые и хронические, причем последние развиваются постепенно и могут протекать бессимптомно или со слабо выраженными проявлениями. Однако в последствии хронические отравления приводят к нарушениям кроветворения, нервной системы и прочим серьезным нарушениям здоровья.
Интересные факты
В тонне гранитной породы (уранинит, монацит, урановые слюдки) содержится примерно 25 грамм урана. Энергия, способная выделиться при сгорании в реакторе этих 25 грамм, сравнима с энергией, которая выделяется при сгорании 125 тонн каменного угля в топках мощных тепловых котлов (Украина - страна ядерных реакторов, АЭС, атомных станций и ядерного оружия)! Исходя из этих данных, можно предположить, что в недалеком будущем гранитные включения (монациты, уран и пр.) станут считать одним из видов минерального топлива. Всего же в относительно тонком двадцатикилометровом поверхностном слое земной коры содержится примерно 1014 тонн урана, при переводе в энергетический эквивалент получается просто колоссальная цифра - 2,36 * 1024 киловатт-часов. Даже все вместе взятые разрабатываемые, разведанные и предполагаемые месторождения горючих ископаемых не способны дать и миллионной доли этой энергии!
Известно, что урановые сплавы, подвергнутые термической обработке, отличаются большими пределами текучести, ползучести и повышенной коррозионной стойкостью, меньшей склонностью к формоизменению изделий при колебаниях температуры и под воздействием облучения. Исходя из этих принципов, в начале XX века и вплоть до тридцатых годов уран в виде карбида применяли в производстве инструментальных сталей. Кроме того, он шел на замену вольфрама в некоторых сплавах, что было дешевле и доступнее. В производстве ферроурана доля U составляла до 30%. Правда во второй трети XX века такое применение урана сошло на нет.
Как известно в недрах Земли идет постоянный процесс распада изотопов урна и их периодическое получение из космоса в виде болидов (ярко горящие метеоры, часто - предвестники цунами, оставляют дыры в земле). Так вот, учеными было подсчитано, что мгновенное высвобождении энергии всей массы этого металла, заключенного в земную оболочку, разогрело бы нашу планету до температуры в несколько тысяч градусов! Однако такое явление, к счастью, невозможно – ведь выделение тепла идет постепенно - по мере того, как ядра урана и его производных проходят ряд радиоактивных длительных превращений. О продолжительности таких преобразований можно судить по периодам полураспадов природных изотопов урана, например, для 235U он равен 7 * 108 лет, а для 238U - 4,51 * 109 лет. Тем не менее, урановое тепло значительно подогревает Землю. Если бы во всей массе Земли было бы столько же урана, как в верхнем двадцатикилометровом слое, то температура на планете была бы значительно выше, чем сейчас. Однако при продвижении к центру Земли концентрация урана снижается.
В ядерных реакторах отрабатывается лишь незначительная часть загруженного урана, связано это с зашлаковыванием топлива продуктами деления: 235U выгорает, цепная реакция постепенно затухает. Однако ТВЭЛы по-прежнему заполнены ядерным горючим, которое необходимо снова употребить. Для этого старые тепловыделяющие элементы демонтируют и отправляют на переработку - их растворяют в кислотах, а уран извлекают из получившегося раствора методом экстракции, осколки деления, от которых нужно избавиться, остаются в растворе. Таким образом, получается, что урановая промышленность практически безотходное химическое производство!
Заводы по разделению изотопов урана занимают территорию в несколько десятков гектаров, примерно такого же порядка и площадь пористых перегородок в разделительных каскадах завода. Это связано со сложностью диффузионного метода разделения изотопов урана - ведь для того чтобы повысить концентрацию 235U от 0,72 до 99% необходимо несколько тысяч диффузионных ступеней!
Ураново-свинцовым методом геологам удалось узнать возраст самых древних минералов, при исследовании метеоритных пород удалось определить примерную дату зарождения нашей планеты. Благодаря "урановым часам" определили возраст лунного грунта. Что интересно, оказалось, что уже в течение 3 млрд лет на Луне нет вулканической деятельности и естественный спутник Земли остается пассивным телом. Ведь даже самые молодые куски лунного вещества прожили срок больше возраста древнейших земных минералов.
История
Использование урана началось очень давно - еще в I веке до нашей эры природная окись урана использовалась для изготовления желтой глазури, использовавшейся при окраске керамики.
В новое время изучение урана происходило постепенно - несколькими этапами, с непрерывным нарастанием. Началом послужило открытие этого элемента в 1789 году немецким натурфилософом и химиком Мартином Генрихом Клапротом, который восстановил добытую из саксонской смоляной руды ("урановая смолка") золотисто-желтую "землю" (отенит - урановые слюдки, похож на вермикулит для домашних растений) до черного металлоподобного вещества (оксид урана - UO2). Название было дано в честь самой далекой из известных в те времена планет - Урана, которую в свою очередь открыл в 1781 году Уильям Гершель. На этом первый этап в изучении нового элемента (Клапрот был уверен в том, что он открыл новый металл) заканчивается, наступает перерыв более чем на пятьдесят лет.

Метаотенит (золотисто-зеленый, уранове слюдки). Коннектикут, США. Кристаллы до 8 мм. Фото: © А.А. Евсеев.
1840 год можно считать началом новой вехи в истории изучения урана. Именно с этого года проблемой получения металлического урана занялся химик Эжен Мелькиор Пелиго (1811-1890), вскоре (1841) ему это удалось - металлический уран был получен при восстановлении UCl4 металлическим калием. Кроме того, он доказал, что открытый Клапротом уран на самом деле всего его оксид. Также он определил предположительный атомный вес элемента – 120. Затем наступает длительный перерыв в изучении свойств урана.
Лишь в 1874 году появляются предположения о природе урана: Дмитрий Иванович Менделеев, следуя разработанной им теории о периодизации химических элементов, находит место новому металлу в своей таблице, размещая уран в последней клетке. Кроме того, Менделеев увеличивает ранее предполагаемый атомный вес урана в двое, не ошибившись и в этом, что подтвердили опыты немецкого химика Циммермана 12 лет спустя.
С 1896 года открытия в области изучения свойств урана "посыпались" одно за другим: в упомянутом выше году (при исследовании фосфоресценции кристаллов уранилсульфата калия) 43-летний профессор физики Антуан Анри Беккерель открывает "Лучи Беккереля", впоследствии переименованные в радиоактивность. В том же году Анри Муассан (химик) разрабатывает способ получения химически-чистого металлического урана (облучается). И урану посвящен "Капитал" К. Маркса (Ф. Энгельс пишет о красной киновари - руде на ртуть).
В 1899 году Эрнестом Резерфордом была обнаружена неоднородность излучения урановых препаратов. Выяснилось, что есть два вида излучения - альфа- и бета-лучи, различные по своим свойствам: они несут различный электрический заряд, имеют различную длину пробега в веществе и ионизирующая способность их также различна. Годом позже были обнаружены и гамма-лучи Полем Вийаром.
Эрнест Резерфорд и Фредерик Содди совместно разработали теорию радиоактивности урана. На основе этой теории в 1907 году Резерфорд предпринял первые опыты по определению возраста минералов при изучении радиоактивных урана и тория. В 1913 году Ф. Содди ввел понятие об изотопах (от древне-греческого изо - "равный", "одинаковый", и топос - "место"). В 1920 году этот же ученый предположил, что изотопы иногда (если нет заражения ураном дополнительно) можно использовать для определения геологического возраста горных пород. Его предположения оказались верны: в 1939 г. Aльфред Oтто Карл Нир оздал первые уравнения для расчета возраста и применил масс-спектрометр для разделения изотопов.
В 1934 году Энрико Ферми провел ряд опытов по бомбардировке химических элементов нейтронами - частицами, открытыми Дж. Чедвиком в 1932 году. В результате этой операции в уране появлялись неизвестные прежде радиоактивные вещества. Ферми и другие ученые, участвовавшие в его опытах, предположили, что им удалось открыть трансурановые элементы. В течение четырех лет предпринимались попытки обнаружения трансурановых элементов среди продуктов нейтронного обстрела.
Закончилось все в 1938 году, когда немецкие ученые Отто Ган и Фриц Штрассман установили, что, захватывая свободный нейтрон, ядро изотопа урана 235U делится, при этом выделяется (в расчете на одно ядро урана) достаточно большая энергия, в основном, за счет кинетической энергии осколков и излучения. Продвинутся дальше немецким ученым не удалось. Это открытие было истоком использования внутриатомной энергии, как в мирных, так и в военных целях (г. Харьков северо-востока Украины - основоположник военных ядерных взрывов - Ландау, критическая масса урана определена диаметром шара урана 9,9 см).
ДОПОГ 1 
Бомба, которая взрывается
Могут характеризоваться рядом свойств и эффектов, таких как: критической массой; разбросом осколков; интенсивный пожар/тепловой поток; яркая вспышка; громкий шум или дым.
Чувствительность к толчкам и/или ударам и/или теплу
Использовать укрытие, при этом держаться на безопасном расстоянии от окон
Оранжевый знак, изображение бомбы при взрыве
ДОПОГ 7 

Радиоактивные материалы (радиация, Украина)
Риск поглощения внешнего и внутреннего радиационного облучения
Ограничить время влияния, ожоги радиацией, радиационная засветка фото- и киноматериалов
Желтая верхняя половина ромба, белая - нижняя, равновеликие, номер ДОПОГ, черный знак радиации, надпись
ДОПОГ 7 





Радиоактивные материалы
Риск поглощения внешнего и внутреннего радиационного облучения
Ограничить время влияния, ожоги радиацией, радиационная засветка фото- и киноматериалов
Белая, желтая верхняя половина ромба, белая - нижняя, номер ДОПОГ, черный знак радиации, текст
Активные однокомпонентные (обедненные) радиационные материалы. Белый ромб, одна вертикальная красная черта внизу - нет ядерного боезаряда (в т.ч. простая водородная бомба на ядерном взрывателе, обедненный уран, прожигающая боеголовка "Косово", ЕС, однокомпонентная без ядерного взрыва). Компетенция - метрология Украины.
Желтый ромб, две вертикальные краснае черты внизу - активный одинарный ядерный заряд (уран, ядерная бомба по типу "Хиросима", в том числе многокомпонентные однотипные ядерные части единого боезаряда, однококпонентный взрыв и простая цепная ядерная реакция - "два в одном"). Компетенция - полиция Украины и военный правопорядок.
Желтый ромб, три вертикальные красные черты внизу - активный двойной рапзнокомпонентный ядерный заряд (плюс дейтерий-тритий, термоядерная бомба типа "Тихий океан", в том числе ядерные части дуплексного боезаряда, цепной ядерный взрыв и цепная темоядерная реакция - "три в одном"). Компетенция - военные Украины и военный правопорядок.
ДОПОГ 7Е 
Радиоактивные материалы делимые (в процессе взрыва)
Опасность возникновения ядерной цепной реакции (ядерная рекация, взрыв). Активные однокомпонентные (обедненные) радиационные материалы.
Белая верхняя половина ромба, белая - нижняя, равновеликие, номер ДОПОГ, черный знак радиации, текст

Возможные знаки обозначения опасных грузов по системе ДОПОГ (полиция, Украина)
для возможной перевозки (водородной) ядерной бомбы мини-тягачем (ТС), транспорт - в США

Возможные знаки для перевозки особо опасных военных грузов ДОПОГ (военные, водородная бомба)
Нет "стены" ударной волны (разрушения типа "ковш экскаватора") и эффекта искусcтвенного цунами
Дополнительные компоненты ядерной бомбы - водород, дейтерий, тритий. Результат - гелий и литий
Как исходные использованы фото военного веб-сайта http://http://wartime.org.ua/

Уранинит - особо опасный радиоактивный минерал (образец камней и минералов, опасный для жизни
и здоровья человека), перевозка по системе ДОПОГ опасные грузыУ N 7 обязательна (вечером, ночью)
Нахождение в природе
Среднее содержание урана в земной коре (кларк) 3∙10-4% по массе, это означает, что его больше в недрах земли, чем серебра, ртути, висмута. Уран характерный элемент для гранитного слоя и осадочной оболочки земной коры. Так, в тонне гранита - около 25 грамм элемента N 92. Всего в относительно тонком, двадцатикилометровом, верхнем слое Земли заключено более 1000 тонн урана. В кислых изверженных породах 3,5∙10-4%, в глинах и сланцах 3,2∙10-4%, особенно обогащенных органикой, в основных породах 5∙10-5%, в ультраосновных породах мантии 3∙10-7%.
Уран энергично мигрирует в холодных и горячих, нейтральных и щелочных водах в виде простых и комплексных ионов, особенно в форме карбонатных комплексов. Немаловажную роль в геохимии урана играют окислительно-восстановительные реакции, все потому, что соединения урана, как правило, хорошо растворимы в водах с окислительной средой и плохо растворимы в водах с восстановительной средой (сероводородах).
Известно более сотни минеральных руд урана, они различны по химическому составу, происхождению, концентрации урана, из всего многообразия лишь дюжина представляет практический интерес. Основными представителями урана, имеющими наибольшее промышленное значение, в природе можно считать окислы - уранинит и его разновидности (настуран и урановая чернь), а также силикаты - коффинит, титанаты - давидит и браннерит; водные фосфаты и арсенаты уранила - урановые слюдки.
Уранинит - UO2 присутствует преимущественно в древних - докембрийских породах в виде четких кристаллических форм. Уранинит образует изоморфные ряды с торианитом ThO2 и иттро-церианитом (Y,Ce)O2. Кроме того, все ураниниты содержат продукты радиогенного распада урана и тория: K, Po, He, Ac, Pb, а также Ca и Zn. Собственно уранинит – высокотемпературный минерал, характерен для гранитных и сиенитовых пегматитов в ассоциации со сложными ниобо-тантало-титанатами урана (колумбит, пирохлор, самарскит и другие), цирконом, монацитом. Кроме того, уранинит встречается в гидротермальных (вторично), скарновых (третично) и осадочных породах (метаморфит). Месторождения уранинита известны в Канаде, Африке, Соединенных Штатах Америки, Франции и Австралии.
 Настуран (U3O8), он же урановая смолка или смоляная обманка - пожирает плоть, "Ад Украины", образующий скрытокристаллические колломорфные агрегаты - вулканогенный и гидротермальный минерал, представлен в палеозойских и более молодых высоко- и среднетемпературных образованиях.
Настуран (U3O8), он же урановая смолка или смоляная обманка - пожирает плоть, "Ад Украины", образующий скрытокристаллические колломорфные агрегаты - вулканогенный и гидротермальный минерал, представлен в палеозойских и более молодых высоко- и среднетемпературных образованиях.
Постоянные спутники настурана – сульфиды, арсениды, самородные висмут, мышьяк и серебро, карбонаты и некоторые другие элементы (признак актичной вулканической возгонки, молодые вулканические трещины к батолитам и гидротермальные осушаемые жаром активного батолита пегматитовые поля).
Эти руды очень богаты ураном, но редко встречаются, зачастую в сопровождении радия, это объяснимо: радий является продуктом изотопного распада урана (но не обязательно, обогащают и извлекают - обыкновенной промышленной пластовой самородной серой, Плиний Старший, а далее восстанавливают самородным пластовым углем-антрацитом Донецкой области юго-востока Украины и углеродом - как красную киноварь, "Генезис руд").
Крупнейшие месторождения - Украина (Луганская и Житомирская обл., урановые рудники "Ад Данте" и "Елисейские поля"). Месторождения урановых руд также расположены в США (шт. Колорадо, Северная и Южная Дакота), Канаде (провинции Онтарио и Саскачеван), ЮАР (Витватерсранд), Франции (Центральный массив), Австралии (Северная территория) и многих других странах.
В России основным урановорудным регионом является Забайкалье. На месторождении в Читинской области РФ (около города Краснокаменск) добывается около 93% российского урана.
 Урановые "черни" или "земли" (рыхлые землистые агрегаты - более черный уранинит и коричеватый настуран, модифицируется на воздухе, камень, который ест плоть) представлены в основном в более молодых - кайнозойских и моложе образованиях, характерны для гидротермальных (вулканических сухих возгоночных) сульфидно-урановых и осадочных месторождений.
Урановые "черни" или "земли" (рыхлые землистые агрегаты - более черный уранинит и коричеватый настуран, модифицируется на воздухе, камень, который ест плоть) представлены в основном в более молодых - кайнозойских и моложе образованиях, характерны для гидротермальных (вулканических сухих возгоночных) сульфидно-урановых и осадочных месторождений.
Также уран извлекается в виде побочного продукта из руд, содержащих менее 0,1%, например, из золотоносных конгломератов или материнской породы ванадинита.
Содержание урана в земной коре постепенно уменьшается за счет радиоактивного распада и пребывает за счет метеоритного урана (горящие в атмосфере метеориты болиды).
В связи с этим процессом связано накопление в земной коре атомов свинца и гелия. Радиоактивный распад урана играет определенную роль в энергетике земной коры, являясь источником глубинного тепла планеты красного цвета (тип "красный карлик", а не "голубой гигант" - термоядерная реакция на дейтерии и тритии - гелий и литий).
Применение
Современная атомная энергетика немыслима без элемента N 92 и его свойств. Хотя еще не так давно - до запуска первого ядерного реактора (АЭС, базовая - Запорожская АЭС, центральная Украина) урановые руды добывались для извлечения из них радия (наркотик). Небольшие количества урановых соединений использовали в красителях и катализаторах. По сути дела, уран считался элементом, который не имеет промышленного значения, и как изменилась ситуация после открытия способности изотопов урана к делению! Этот металл мгновенно получил статус стратегического сырья N 1.
В наше время основная область применения металлического урана, так же как и его соединений - топливо для ядерных реакторов. Так в стационарных реакторах АЭС применяется малообогащенная (природная) смесь изотопов урана, а в силовых ядерных установках и в реакторах на быстрых нейтронах используется уран высокой степени обогащения.
Наибольшее применение имеет изотоп урана 235U, ведь в нем возможна самоподдерживающаяся цепная ядерная реакция, что не характерно для других изотопов урана. Благодаря именно этому свойству 235U используется как топливо в ядерных реакторах, а также в ядерном оружии. Однако выделение изотопа 235U из природного урана - сложная и дорогостоящая технологическая проблема.
Самый распространенный в природе изотоп урана 238U может делиться, если его бомбардируют высокоэнергетическими нейтронами. Такое свойство данного изотопа используют для увеличения мощности термоядерного оружия - используются нейтроны, порожденные термоядерной реакцией. Кроме того, из изотопа 238U получают изотоп плутония 239Pu, который в свою очередь также может использоваться в ядерных реакторах и в атомной бомбе. В последнее время большое применение находит получаемый в реакторах из тория изотоп урана 233U, его получают, облучая в нейтронном потоке ядерного реактора торий:
23290Th + 10n → 23390Th –(β–)→ 23391Pa –(β–)→ 23392U
233U делится скоростными (плазменными, высокая температура) нейтронами, кроме того, в реакторах с 233U может происходить расширенное воспроизводство ядерного горючего. Так при выгорании в ториевом реакторе килограмма 233U в нем же должно накопиться 1,1 кг нового 233U (в результате захвата нейтронов ядрами тория). В ближайшем будущем уран-ториевый цикл в реакторах на тепловых нейтронах - главный конкурент уран-плутониевого цикла воспроизводства ядерного горючего в реакторах на быстрых нейтронах. Уже сейчас существуют и работают реакторы, использующие этот нуклид в качестве топлива (KAMINI в Индии). 233U также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей. Другие искусственные изотопы урана не играют заметной роли.
После того, как из природного урана извлекают "нужные" изотопы 234U и 235U, оставшееся сырье (238U) носит название "обедненный уран", он в два раза менее радиоактивен, чем природный уран, в основном за счет удаления из него 234U. Так как основное использование урана - производство энергии, по этой причине обедненный уран - малополезный продукт с низкой экономической ценностью. Однако из-за своей низкой цены, а также большой плотности и чрезвычайно высокого сечения захвата он используется для радиационной защиты, и как балластная масса в аэрокосмических применениях, таких как рулевые поверхности летательных аппаратов. Кроме того, обедненный уран применяется как балласт в космических спускаемых аппаратах и гоночных яхтах; в высокоскоростных роторах гироскопов, больших маховиках, при бурении нефтяных скважин.

Возможные знаки опасных грузов по системе ДОПОГ (Украина) для военного железнодорожного состава
Однако самое известное применение обедненного урана - это использование его в военных целях - в качестве сердечников для бронебойных снарядов и в современной танковой броне, например, танка M-1 "Абрамс" (операции в Косово и т.п.). Менее известные области применения урана в основном связаны с его соединениями. Так малая добавка урана придает красивую желто-зеленую флуоресценцию стеклу, некоторые соединения урана светочувствительны, по этой причине уранилнитрат широко применялся для усиления негативов и окрашивания (тонирования) позитивов (фотографических отпечатков) в бурый цвет.
Карбид 235U в сплаве с карбидом ниобия и карбидом циркония применяется в качестве топлива для ядерных реактивных двигателей. Сплавы железа и обедненного урана (238U) применяются как мощные магнитострикционные материалы. Уранат натрия Na2U2O7 использовался как желтый пигмент в живописи, ранее соединения урана применялись как краски для живописи по фарфору и для керамических глазурей и эмалей (окрашивают в цвета: желтый, бурый, зеленый и черный, в зависимости от степени окисления, поэтому Ландау их называет "земли").
Производство
Уран получают из урановых руд, которые значительно различаются по ряду признаков (по условиям образования, по "контрастности", по содержанию полезных примесей и др.), основным из которых является процентное содержание урана. Согласно этому признаку различают пять сортов руд: очень богатые (содержат свыше 1% урана); богатые (1-0,5%); средние (0,5-0,25%); рядовые (0,25-0,1%) и бедные (менее 0,1%). Однако даже из руд, содержащих 0,01-0,015% урана, этот металл извлекается в качестве побочного продукта.
За годы освоения уранового сырья разработано немало способов выделения урана из руд (большинство из них не базируется на народном опыте и поэтому нетехнологичны). Это связано и со стратегическим значением урана в некоторых областях, и с разнообразием его природных проявлений. Далее в зависимости от назначения получаемого урана, следует обогащение продукта изотопом 235U или восстановление элементарного урана.
Итак, первоначально происходит концентрирование руды - порода измельчается и далее ошибка технологического цикла - порода просто заливается водой. И руда ценного и дорогого металла сразу испорчена - нужно работать по принципу знаменитого ртутного комбината в Ферганской Долине Киргизии, Хайдаркан - "Великий рудник", Средняя Азия - добавить один технологический цикл, выполнить сульфидизацию урана самородоной серой, например, из Италии юга Еврошенгена). Из всех руд сульфиды ("сухие" и бескислородные соединения серы) - самые желаемые (наиболее богатые, в т.ч. искусственные сульфиды - из оксидов на природном катализаторе мышьяке и пр.).

Минимальная маркировка при перевозке опасных грузов по системе ДОПОГ (ДОПНВ) опасный груз (при наличии
оранжевых проблесковых маяков). Перевозка - ночью. Токсические ядерные отходы. Маркировки отходов нет (выпарены).
Ошибка аферистов из Харьковского физико-технического института (22 марта 2012 г.) - маркировка, компетенция полиции
Физические свойства
Металлический уран - очень тяжелый, он тяжелее железа в два с половиной раза, а свинца - в полтора! Это один из самых тяжелых элементов, которые хранятся в недрах Земли. Своим серебристо-белым цветом и блеском уран напоминает сталь. Чистый металл пластичен, мягок, имеет высокую плотность, но в тоже время поддается обработке.
Уран электроположителен, обладает незначительными парамагнитными свойствами - удельная магнитная восприимчивость при комнатной температуре 1,72·10-6, имеет малую электропроводность, но высокую реакционную способность. Этот элемент имеет три аллотропических модификации: α, β и γ. α-форма имеет ромбическую кристаллическую решетку со следующими параметрами: a = 2,8538 Å, b = 5,8662 Å, с = 4б9557 Å. Эта форма стабильна в температурном коридоре от комнатных температур до 667,7o C. Плотность урана в α-форме при температуре 25o C составляет 19,05 ±0,2 г/см3. β-форма имеет тетрагональную кристаллическую решетку, стабильна в интервале температур от 667,7o C до 774,8o C.
Параметры четырехугольной решетки: a = 10,759 Å, b = 5,656 Å. γ–форма с объемно-центрированной кубической структурой, стабильна от 774,8o C до точки плавления (1132o C). Увидеть все три фазы можно в процессе восстановления урана. Для этого используется специальный аппарат, который представляет собой стальную бесшовную трубу, которая футеруется оксидом кальция, это необходимо, чтобы сталь трубы не взаимодействовала с ураном. В аппарат загружают смесь тетрафторида урана и магния (или кальция), после чего нагревают до 600o C.
При достижении этой температуры включают электрический запал, мгновенно протекает экзотермическая реакция восстановления, при этом загруженная смесь полностью плавится. Жидкий уран (температура 1132o C) за счет своего веса полностью опускается на дно. После полного осаждения урана на дно аппарата начинается охлаждение, уран кристаллизуется, его атомы выстраиваются в строгом порядке, образуя кубическую решетку - это и есть γ-фаза. Следующий переход происходит при 774o C - кристаллическая решетка остывающего металла становится тетрагональной, что соответствует β-фазе. Когда температура слитка падает до 668o C, атомы вновь перестраивают свои ряды, располагаясь волнами в параллельных слоях - α-фаза. Далее никаких изменений уже не происходит.
Основные параметры урана всегда относятся к α-фазе. Температура плавления (tпл) 1132o С, температура кипения урана (tкип) 3818o С. Удельная теплоемкость при комнатной температуре 27,67 кдж/(кг·К) или 6,612 кал/(г·o С). Удельное электрическое сопротивление при температуре 25o С примерно 3·10-7 ом·см, а уже при 600o С 5,5·10-7 ом·см. Теплопроводность урана также меняется в зависимости от температуры: так в интервале 100-200o С она равна 28,05 вт/(м·К) или 0,067 кал/(см·сек·o С), а при повышении до 400o С увеличивается до 29,72 вт/(м·К) 0,071 кал/(см·сек·o С). Уран обладает сверхпроводимостью при при 0,68 К. Средняя твердость по Бринеллю 19,6 - 21,6·102 Мн/м2 или 200-220 кгс/мм2.
Многие механические свойства 92-го элемента зависят от его чистоты, от режимов термической и механической обработки. Так для литого урана предел прочности при растяжении при комнатной температуре 372-470 Мн/м2 или 38-48 кгс/мм2, среднее значение модуля упругости 20,5·10-2 Мн/м2 или 20,9·10-3 кгс/мм2. Прочность урана повышается после закалки из β- и γ-фаз.
Многие Облучение урана потоком нейтронов, взаимодействие с водой, охлаждающей топливные элементы из металлического урана, другие факторы работы в мощных реакторах на тепловых нейтронах - все это приводит к изменениям физико-механических свойства урана: металл становится хрупким, развивается ползучесть, происходит деформация изделий из металлического урана. По этой причине в ядерных реакторах используются урановые сплавы, например с молибденом, такой сплав устойчив к действию воды, упрочняет металл, сохраняя высокотемпературную кубическую решетку.
Химические свойства
В химическом отношении уран весьма активный металл. На воздухе он окисляется с образованием на поверхности радужной пленки двуокиси UO2, которая не предохраняет металл от дальнейшего окисления, как это происходит с титаном, цирконием и рядом других металлов. С кислородом уран образует двуокись UO2, трехокись UO3 и большое количество промежуточных окислов, важнейшим из которых является U3O8, по свойствам эти окислы сходны с UO2 и UO3. В порошкообразном состоянии уран пирофорен и может воспламениться при незначительном нагреве (150oC и выше), горение сопровождается ярким пламенем, в итоге образуется U3O8.
При температуре 500-600oC уран взаимодействует с фтором с образованием малорастворимых в воде и кислотах игольчатой формы кристаллов зеленого цвета - тетрафторида урана UF4, а также UF6 - гексафторида (белые кристаллы, возгоняемые без плавления при температуре 56,4oC). UF4, UF6 - примеры взаимодействия урана с галогенами с образованием галогенидов урана.
Уран легко соединяется с серой, образуя ряд соединений, из которых наибольшее значение имеет US - ядерное горючее. С водородом уран взаимодействует при 220oC с образованием гидрида UH3, который химически очень активен. При дальнейшем нагреве UH3 разлагается на водород и порошкообразный уран.
Взаимодействие с азотом происходит при более высоких температурах - от 450 до 700oC и атмосферном давлении получается нитрид U4N7, с повышением давления азота при тех же температурах можно получить UN, U2N3 и UN2. При более высоких температурах (750-800oC) уран взаимодействует с углеродом с образованием монокарбида UC, дикарбида UC2, а также U2C3.
Уран взаимодействует с водой с образованием UO2 и H2, причем с холодной водой медленнее, а с горячей активнее. Кроме того, реакция протекает и с водяным паром при температурах от 150 до 250oC. Этот металл растворяется в соляной HCl и азотной HNO3 кислотах, менее активно в сильно концентрированной плавиковой кислоте, медленно реагирует с серной H2SO4 и ортофосфорной H3PO4 кислотами. Продуктами реакций с кислотами являются четырехвалентные соли урана. Из неорганических кислот и солей некоторых металлов (золото, платина, медь, серебро, олово и ртуть) уран способен вытеснять водород. Со щелочами уран не взаимодействует.
В соединениях уран способен проявлять следующие степени окисления: +3, +4, +5, +6, иногда +2. U3+ в природных условиях не существует и может быть получен только в лаборатории. Соединения пятивалентного урана по большей части не устойчивы и довольно легко разлагаются на соединения четырех и шестивалентного урана, которые являются наиболее устойчивыми. Для шестивалентного урана характерно образование иона уранила UO22+, соли которого окрашены в желтый цвет и хорошо растворимы в воде и минеральных кислотах. Примером соединений шестивалентного урана может послужить триоксид урана или урановый ангидрид UO3 (оранжевый порошок), имеющий характер амфотерного оксида.
При растворении которого в кислотах образуются соли, например уранилхлорид урана UO2Cl2. При действии щелочей на растворы солей уранила получаются соли урановой кислоты H2UO4 - уранаты и двуурановой кислоты H2U2O7 - диуранаты, например, уранат натрия Na2UO4 и диуранат натрия Na2U2O7. Соли четырехвалентного урана (тетрахлорид урана UCl4) окрашены в зеленый цвет и менее растворимы. При длительном нахождении на воздухе соединения, содержащие четырехвалентный уран обычно нестабильны и обращаются в шестивалентные. Ураниловые соли, такие как уранилхлорид распадаются в присутствии яркого света или органики.
Источник: за основу интернет-публикации взят материал веб-сайта http://i-Think.ru/.
Добыча урана - открытые конусовидные карьеры ступенями (уступами, кимберлитовые трубки)
Существуют правила и законы, определяющие меры по охране окружающей среды как обязательный элемент при проектировании добычи урана и попутных к нему материалов (алмазы, киноварь, газ, вода и др.). Они оговаривают такие требования, как оценки воздействия урана, серы, киновари и других составляющих месторождения на окружающую среду; постепенное проведение программы восстановления, включая восстановление ландшафтов и лесных массивов, посадка эндогенной флоры, восстановление эндогенной дикой природы; а также одномоментные и долговременные проверки дозиметрического соответствия состояния окружающей средысуществующим нормам (в г. Харькове, северо-восток Украины - 17-19 и до 23 миллирентген/час, с 2011 г. кимберлитовая трубка "Харьков"). Идеальное место для курорта - на вулкане (с мая 2010 г.). Разработка открытым карьером - запрещена.

Пример кимберлитовой трубки, г. Мирный, Сибирь (РФ), глубина 525 м, диаметр воронки - 1,25 км

Гипотетическая кимберлитовая трубка (не г. Харьков, Украина) с возможной разметкой (на воду)

Современная ПК ЭВМ 32-разр. современная палитра на видимость структуры кимберлитовой трубки
(находящейся в стадии активной разработки, не г. Харьков), ПК ЭВМ симуляция биологического восприятия
Для окружающей среды открытая добыча урана "кимберлитовой трубкой" (типа ЮАР, Африка и др.) может представлять серьезную опасность для экологии из-за пылеуноса радиоактивной пыли и ее вдыхания (рак легких). Изменения ландшафтов, нарушение растительного покрова, неблагоприятные воздействия на флору и фауну, -это неизбежные последствия открытых разработок (пример экологически чистой отработки "на курорте" - Ферганская долина Киргизии и шахты г. Альмаден в Испании - киноварь). Загрязнение поверхностных и грунтовых вод порождает проблемы, особенно при откачивании грунтовых выщелачивающих жидкостей при добыче растворением и сливе жидкостей при гидравлической разработке (из подземных источников природной воды, типа "Харьковская-1").

Псевдомалахит ("элит") - синевато-зеленый прожилок в малахите (полосой в центре).
Меднорудянский р-к, Ниж. Тагил, Ср. Урал, Россия, СНГ. Фото: © А.А. Евсеев.
Вокруг голубоватого псевдомалахита - остеклованный зеленый малахит типа кимберлитового
тектита, результат вхождения в литосферные слои и породы земной коры раскаленного уранового
метеоритного болида и формирования сквозной кимберлитовой трубки в земле, пробой до магмы.
Землетрясение, убегают крысы, прячутся домашние животные, мор (болезни и смерти), "Апокалипсис"
Малахит Cu2 (CO3) * (OH)2
Псевдомалахит Cu5 (PO4)2 * H2O
Сведем формулы по одинаковому количеству атомов меди:
Малахит 5 х (Cu2 (CO3) * (OH)2
Псевдомалахит 2 х (Cu5 (PO4)2 * (H2O)
Разберем формулы по количеству атомов:
Малахит Cu10 (C5 O15) * O10 H10
Псевдомалахит Cu10 (P4 O16) * H4 O2
Малахит Cu10 C5 O25 * H10
Псевдомалахит Cu10 P4 O18 * H4 - добавили фосфор P
Разница атомов - C5 O7 * H6 = 3 х (H2O) + 5 х C + O4 (*)
- углерод (алмаз) = 3 х (H2O) + 2 х (CO2) + C3 (**)
- углерод (карбонадо) = 3 х (H2O) + 2 х (CO) + (CO2) + C2 (***)
- комбинация атомов ("СО") = 5 х (CO) + O2 + 3 х H2 (****, "газ")
- комбинация атомов ("СО") = 5 х (CO) + 2 х (HO2) + H2 (****, "вода")
(*) Примечание. Не существует долго в присутствии дополнительных химических и физических комбинация атомов кислорода O4 (фулера). Распадается на O4 -> 2 х O2 (атомы кислорода) или свободный атом кислорода и озон, при ударе молнии: O4 -> O (атом уходит вверх на границу атмосферы, озон) + O3 (свободный озон, накапливается у поверхности земли, тяжелый). Углеродные фулеры C5 - шунгит в Карелии (СНГ), лечатся - выходами кислорода (фурелы и др). Лучший кислородный санаторий (Карелия, РФ (СНГ) - лечатся на севере Европы, РФ (СНГ), Петр I).
(**) Примечание. Наиболее привлекательная, алмазоносная кимберлитовая трубка ("Большая Яма" Кимберли в ЮАР, "Мир", "Удачная" в РФ (СНГ), "ИнГОК" в Украине, СНГ) - формируется черный свободный газ углерод C, серый жидкий графит C2 (связанный) и белый твердый алмаз C3 или карбонадо (смесь углеродов в кристалле). Химическая активность кимберлитовых трубок - вдыхание углерода С -> СO -> СO2 (удушье, малокровие, отнимает атом кислорода у гемоглобина крови), разъедание графитом (язвы), смерть (алмазификация организма, кристаллы, силикоз). Источники воды типа "Миргород", белая (невозможно напиться - иметь питьевую альтернативу).
(***) Примечание. Ядовитый даже в малых дозах угарный газ СO и углерод С. Отравления (обморок). Отравления углекислым газом CO2 - забор углекислого газа для нужд промышленности (газированная вода, "содовая", "американский синдром", типа "Кисловодск", нарзан, РФ, СНГ).
(****) Примечание. Сочетание атомов C5 * O7 * H6. Угарный газ СO с кислородом и водородом, опасное трудно диагностируемое сочетание. Есть "сухая" и "мокрая" (с водой, пар, кальдера). При выходах сухих вулканических гаджов отбирают кислород и водород (сухие кальдеры). Второй тип - минеральная вода, в горах реки и ручьи, источники (при кипячении выходит водород).
- водород ("бомба") = 5 х (CO) + 2 х (H2O) + H2 (*****)
(*****) Примечание. В связи с ударом радиоактивного урана и т.п. (болид) происходит ядерная и термоядерная реакция и формируется изотоп газа водорода H1 и его редкие изотопы - дейтерий H2 и тритий H3, а также их ядерные и термоядерные производные - жидкий гелий He2 (из дейтерия H2) и литий Li3 (из трития H3). Радиационные поверхностные поражения активным ядерным изотопом водорода H1 (кожа - нейтрон0), термоядерные ожоги He2 (мышцы, мягкие ткани, средняя тяжесть - протон+) и поражения Li3 (обугливание и "углификация" тела, крайне тяжелые поражения и ожоги, "горение тела", смерть, тотальное поражение радиацией - электрон-).
Просуммируем формулы по количеству атомов:
Малахит Cu10 (C5 O15) * O10 H10
Псевдомалахит Cu10 (P4 O16) * H4 O2
Малахит Cu5 (C2 O7) * O5 H5 |
Псевдомалахит Cu10 (P4 O16) * H4 O2 | на фото выше (малахит + псевдомалахит)
Малахит Cu5 (C3 O8) * O5 H5 |
Сумма атомов - Cu20 C5 P4 O43 H14
=> Cu20 + P4 (беларусский тип)
Примечание. Перетирание кимберлита и минералов в зоне активного вращения кимберлитовой трубки (смерч в земле). Формируется самородная медь ("отпечаток солей"), 99,3%, в максимально высоком количестве, восстановление металлической меди (РФ, СНГ) и механический вынос фулер фосфора отдельно, химически активен - болота Беларуси, Европа, СНГ. Кимберлитовая сепарация - быстрое механическое вращение кимберлитовой трубки (торнадо в земле) обеспечивает практически полную сепарацию минералов (РФ, СНГ). Механический разогрев - термальное тепло (огарок).
Химические реакции восстановления меди из солей и отделение фосфора идет в присутствии катализатора азота N, который в химической реакции на финальном процессе не используется и вступает во вторичные химические реакции с оставшимся окружением. Магматический газ N2 (ядерные реакции внутри ядра Земли). Высокое содержание в атомсфере, химически инертный. Дополнительно выделяется цианистый газ - ядовитый, формируются цианиды - ядовитые соединения. Бесцветный ядовитый газ с горьким запахом, состоящий из азота и углерода циан (CN)2. Пример ядовитых сопутствующих соединений сквозной магматической кальдеры - цианистый калий KCN, цианид натрия NaCN (натриевый теплоноситель ядерного реактора АЗС). На основе азота N.
Остаток атомов - -- C5 -- O43 H14 => C5 * O43 * H14 (кимберлит вращения)
Катализатор - N + N2 + Nn (свободный азот, газ, фулеры азота)
Малахит -- (C2 O7) * O5 H5 |
Псевдомалахит -- (-- O16) * H4 O2 | циан (CN)2
Малахит -- (C3 O8) * O5 H5 |
Ядерная реакция U92 (уран) -> N7 (азот) + х85 (85 ед. таблицы Менделеева)
Ядерная реакция U236 (уран) -> N14 (азот) + х222 (222 ед. атомарной массы)
U отнимает 2 атома кислорода O и формирует уранинит UO2, настуран UO2 * n (H2O)
Нестойкий термальный уран U3O8 также опасен, нечем дышать (отнимает кислород)
 Пример близости кимберлитовой трубки третьего типа - уранинит, гуммит по ураниниту (Северная Карелия, РФ, Европейская часть России, СНГ). Его выбрасывает на поверхность кимберлитовая трубка - наподобие земляного торнадо (смерча, тромба). Месторождения урана - Володарск-Волынские пегматиты, Житомирская обл. запада Украины (СНГ) и Луганская область Украины (СНГ), Крым (СНГ). Экономике посвящен "Капитал" (К. Маркс).
Пример близости кимберлитовой трубки третьего типа - уранинит, гуммит по ураниниту (Северная Карелия, РФ, Европейская часть России, СНГ). Его выбрасывает на поверхность кимберлитовая трубка - наподобие земляного торнадо (смерча, тромба). Месторождения урана - Володарск-Волынские пегматиты, Житомирская обл. запада Украины (СНГ) и Луганская область Украины (СНГ), Крым (СНГ). Экономике посвящен "Капитал" (К. Маркс).
Это - кимберлитовые трубки, в которых идет активнейшая ядерная реакция, причем чем глубже в тело сужающееся наподобие морковки тело кимберлитовой трубки (кимберлита), тем выше радиоактивный фон кимберлита. Страшный выдув газа из тела кимберлитовой трубки (т.н. "лазерный"). "Мир" (Якутия, РФ, СНГ).
На фото - полная псевдоморфоза по разноцветному турмалину эльбаиту (форма). Похоже на эльбаитоподобный дравит-шерл (турмалин), но нужен дозиметр. От 18 миллирентген/час - остановка, от 24 миллирентген/час - краткосрочное пребывание, от 32 миллирентген/час - покинуть. От 100 миллирентген/час - смерть. Знаменитые урановые кимберлитовые рудники и копи. Пример радиоактивного выброса - пос. Новогорный (РФ, СНГ), 1987-1989 г, 2 рентгена/час.
Особенности кимберлитов описанных типов (на примере ураново-малахитово-псевдомалахитового типа с активным выбросом кальдеры) - тяжело дышать, не хватает кислорода для дыхания, отравления углеродом, угарным и углекислым газом, отравления кислородом (чистый, яд) и водородно-азотные проблемы атомсферы. Падение уровня атомсферы над кимберлитом, горстово-сбросовые структуры воронкообразного вращения кимберлита в земле (и яма в космосе, стратосфера), выдув газов из земли до "лазерного" ("лучевого") типа, невидимо. Радиоактивно.
Добыча урана - кимберлитовая трубка "Мир" (РФ, СНГ)



Возможные галлюцинации и цветовые искажения восприятия кимберлитовой трубки "Мир" (Якутия, Саха, РФ)
Скачать бесплатно палитры восприятия кимберлитовой трубки "Мир" органами чувств человека (автор, 2014 г.)
ВОДОРОД, Н (лат. hydrogenium; а. hydrogen; н. Wasserstoff; ф. hydrogene; и. hidrogeno), - химический элемент периодической системы элементов Менделеева, который относят одновременно к I и VII группам, атомный номер 1, атомная масса 1,0079. Природный водород имеет стабильные изотопы - протий или водород (1Н, H1), опасный ядерный дейтерий (2Н, H2 или D) и прославленный радиоактивный теромоядерный - тритий (3Н, H3 или Т). Для природных соединений Земли среднее отношение D/Н = (158±2)*10-6 Равновесное содержание 3Н на Земле ~5*1027 атомов.
Водород впервые описал в 1766 г. ученый Г. Кавендиш. При обычных условиях водород - газ без цвета, запаха и вкуса. В природе в свободном состоянии находится в форме молекул Н2. Энергия диссоциации молекулы Н2 - 4,776 эВ; потенциал ионизации атома водорода 13,595 эВ. Водород - самое легкое вещество из всех известных, плотность при 0oС и 0,1 МПа 0,0899 кг/м3; t кипения- 252,6oС, t плавления - 259,1oС; критические параметры: t - 240oС, давление 1,28 МПа, плотность 31,2 кг/ м3. Наиболее теплопроводный из всех газов - 0,174 Вт/(м*К) при 0oС и 1 МПа, удельная теплоемкость 14,208*103 Дж(кг*К).
Жидкий водород очень легок (плотность при -253oС 70,8 кг/м3) и текуч (вязкость при -253oС равна 13,8 сП). В большинстве соединений водород проявляет степень окисления +1 (подобен щелочным металлам), реже -1 (подобен гидридам металлов). В обычных условиях молекулярный водород малоактивен; растворимость в воде при 20oС и 1 МПа 0,0182 мл/г; хорошо растворим в металлах - Ni, Pt, Pd и др. С кислородом образует воду с выделением тепла 143,3 МДж/кг (при 25oС и 0,1 МПа); при 550oС и выше реакция сопровождается взрывом. При взаимодействии с фтором и хлором реакции идут со взрывом. Основные соединения водорода: вода Н2О, аммиак NH3, сероводород Н2S, метан CH4, гидриды металлов и галогенов CaH2, HBr, HCl, органические соединения С2Н4, HCHO, CH3OH, парафины и др.
Водород - распространенный в природе элемент, содержание его в земной коре 1 % (по массе). Главный резервуар водорода на Земле - вода гидросферы (11,19%, по массе). Водород - один из основных компонентов природных органических соединений. В свободном состоянии присутствует в вулканических и других природных газах, в атмосфере (0,0001%, по числу атомов). Составляет основную часть массы Солнца, звезд, межзвездного газа, газовых туманностей. В атмосферах планет присутствует в форме Н2, CH4, NH3, Н2О, CH, NHOH и др. Входит в состав корпускулярного излучения Солнца (потоки протонов) и космических лучей (потоки электронов).
Сырье для промышленного получения водорода - кимберлиты, газы нефтепереработки, природные газы, продукты газификации угля и др. Основные способы получения водорода: реакция углеводородов с водяным паром, неполное окисление углеводородов кислородом, конверсия окиси углерода, электролиз воды. Водород применяют для производства аммиака, спиртов, синтетического бензина, соляной кислоты, гидроочистки нефтепродуктов, резки металлов водородно-кислородным пламенем. Водород - перспективное газообразное горючее (NASA). Дейтерий и тритий нашли применение в атомной энергетике (АЭС). По материалам: http://www.mining-enc.ru
 ВОДА (а. water; н. Wasser; ф. eau; и. agua) - распространенное в природе простейшее, устойчивое в обычных условиях стойкое химическое соединение водорода с кислородом, Н2О (11,19% водорода и 88,81% кислорода, по массе); бесцветная жидкость (в толстых слоях - голубоватого цвета от водрода, эффект р. Волга, РФ (СНГ), и зеленоватого цвета - море, медь и золото) без запаха и вкуса. Коричневая - битум (р. Дон). Воде принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической и химической среды, климата и погоды. Вода - обязательный компонент практически всех технологических процессов (гидравлика, с 1969 г. - на кимберлитах).
ВОДА (а. water; н. Wasser; ф. eau; и. agua) - распространенное в природе простейшее, устойчивое в обычных условиях стойкое химическое соединение водорода с кислородом, Н2О (11,19% водорода и 88,81% кислорода, по массе); бесцветная жидкость (в толстых слоях - голубоватого цвета от водрода, эффект р. Волга, РФ (СНГ), и зеленоватого цвета - море, медь и золото) без запаха и вкуса. Коричневая - битум (р. Дон). Воде принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической и химической среды, климата и погоды. Вода - обязательный компонент практически всех технологических процессов (гидравлика, с 1969 г. - на кимберлитах).
Изотопный состав воды. В связи с существованием двух стабильных изотопов у водорода 1Н (H1) и 2Н, D (H2), обычно обозначаемых Н и D (дейтерий), и трех у кислорода (16О, 17О и 18О) известно 9 изотопных разновидностей воды. Особый интерес представляет тяжелая вода D2О. Физические свойства воды и их аномалии определяются тем, что ее молекулы объединяются в комплексы водородными связями (кимберлит уранового и ииного типа). Существует ряд гипотетических структурных моделей воды, требующих дальнейшего уточнения.
Структура воды отличается неустойчивостью различного характера, т.к. водородная связь примерно в 10 раз сильнее обычного межмолекулярного взаимодействия (угол между химическими связями 104o27') - возможно присоединение атомов углерода C и формирования спорадических органических соединений. Структура воды зависит от характера и концентрации примесей, присутствующих в ней в ионной, молекулярной и фулерной (объемной, сетчатообразной) формах. Различные ионы, молекулы растворенных газов могут изменять структуру воды, например, мелкие атомы гелия и молекулы водорода могут помещаться в химической структуре воды без нарушения ее водородных и иных связей.
Распределение электронной плотности в молекуле воды таково, что создаются 4 полюса зарядов: 2 положительных, связанных с атомами водорода, и 2 отрицательных, связанных с электронными облаками необобществленных пар электронов атома кислорода. Указанные полюса зарядов располагаются в вершинах тетраэдра. Благодаря этой полярности вода имеет дипольный момент (1,86 D). Кристаллическая структура обычного льда гексагональная, "рыхлая" (водород), в ней много "пустот" (при плотной "упаковке" молекул воды в кристаллах льда его плотность составила около 1600 кг/м3). В жидкой воде присущая льду связь каждой молекулы Н2О с четырьмя соседними ("ближний порядок") в значительной степени сохраняется; однако "рыхлость" структуры при плавлении льда уменьшается, молекулы "дальнего порядка" попадают в "пустоты", что ведет к росту плотности воды.
Многие физические свойства обычной воды (раствор) обнаруживают существенные аномалии. Плотность воды достигает максимального значения 1000 кг/м3 при +3,98oС; при дальнейшем охлаждении она уменьшается, а при замерзании скачкообразно падает (присутствует кимберлитовый водород - катализаторы, формирование дендритов, твердых растворов и рыхлых масс), тогда как у остальных веществ кристаллизация сопровождается увеличением плотности (без примесей).
Вода способна к значительному переохлаждению, т.е. может оставаться в жидком состоянии ниже температуры плавления (даже при -30oС) - дистиллированная, без примесей инородных зародышевых центров кристаллизации. Вязкость воды, с ростом давления уменьшается, а не повышается, как у других жидкостей. Сжимаемость воды крайне невелика и с ростом температуры уменьшается. Некоторые аномалии ослабевают по мере минерализации воды и даже исчезают в насыщенных растворах. Свойства воды могут значительно изменяться в зависимости от естественных условий, существующих в природе, или искусственно создаваемых (действие температуры и давления, магнитных полей).
Химические свойства воды в обычных условиях. Вода - достаточно устойчивое соединение, распад молекул Н2О становится заметным лишь выше 1500oС. Вода взаимодействует со многими основными и кислотными окислами, образуя соответственно основания и кислоты. Присоединение воды к молекулам непредельных углеводородов лежит в основе промышленного способа получения спиртов, альдегидов, кетонов. Вода участвует во многих химических процессах как катализатор. Так, взаимодействие щелочных металлов или водорода с галогенами, многие окислительные реакции не идут в отсутствии хотя бы ничтожных количеств воды.
Газы (водород, гелий и другие кимберлитовые компоненты) достаточно хорошо растворяются в воде, если способны вступать с ней в химические взаимодействия (аммиак, сероводород, сернистый газ, двуокись углерода). Прочие газы менее растворимы в воде. При понижении давления и повышении температуры (до 80oС) растворимость газов в воде, уменьшается. Многие газы при низких температурах и повышении давления не только растворяются в воде, но и образуют кристаллогидраты.
Вода - слабый электролит (литий и т.п.), диссоциирующий по уравнению Н2O <=> H+ + OH-, причем количественной характеристикой электролитической диссоциации воды служит ионное произведение воды: Кв = [ Н+][OH-], где [Н+] и [OH-] - концентрация соответствующих ионов в г-ион/л; Кв составляет 10-14 (22oС) и 72 * 10-14 (100єС). Вода растворяет множество кислот, оснований, минеральных солей. Такие растворы проводят электрический ток благодаря диссоциации растворенных веществ с образованием гидратированных ионов.
Многие вещества при растворении в воде вступают с ней в реакцию обменного разложения, называется гидролизом. Из органических веществ в воде растворяются те, которые содержат полярные группы (-OH, -NH2, -COOH и др.) и имеют не слишком большую молекулярную массу. Сама вода хорошо растворима (или смешивается во всех отношениях) в ограниченном числе органических растворителей. Однако в виде ничтожной примеси к органическим веществам вода присутствует практически всегда и способна резко изменять физические константы последних. В природе вода встречается в виде растворов.
Вода в природе. Природная вода является своеобразным минералом, характеризующимся непостоянным химическим составом, наличием разнообразных примесей, изменяющих ее свойства, и служит объектом добычи, переработки и использования в огромных количествах (около 3 * 1012 м3/год). Океаны, моря, озера, водохранилища, реки, подземные воды, почвенная влага образуют водную оболочку (Гидросфера). В атмосфере вода находится в виде пара, тумана и облаков, капель дождя и кристаллов снега.
В криолитозоне пресные и солоноватые подземные гравитационные воды находятся в виде подземного льда, обусловливая существование мерзлых пород. Подземные льды в мерзлых породах (особенно в дисперсных) изменяют их физические свойства (резко повышают механическую прочность, уменьшают водопроницаемость и т.д.). Соленые подземные воды и рассолы в криолитозоне имеют отрицательные температуры и испытывают при их колебаниях изменения в составе.
В земной коре содержится, по разным оценкам, от 1 до 1,3 млрд. км3 воды. При этом запасы пресных (слабоминерализованных) вод достаточно ограничены, а соленые воды - источники минеральных компонентов типа галит (NaCl - поваренная соль) и т.п.. Значительное количество воды в земной коре находится в связанном состоянии, входя в состав некоторых минералов и горных пород (гипс, гидратированные формы кремнезема, гидросиликаты и др.). Обширный комплекс менающих объем камнй и минералов (вода в пустыне и т.п.).
Конституционная (H2O <=> (OH-) + (Н+)) вода находится в кристаллической решетке минералов в виде ионов OH-, реже - Н+, т.е. образуется при механическом и ином (химическом, электрическом - ионном и радиационном) разрушении кристаллической решетки любого минерала. Кристаллизационная вода занимает определенные места в структуре решетки минерала в виде молекул Н2О. Часть кристаллизационной воды, выделяющейся без разрушения решетки и поглощаемой минералом при изменении внешних условий (нагрев-охлаждение), называется цеолитной. Молекулы адсорбционной воды связаны с поверхностью минеральных кристаллов, образуют гигроскопический слой (в минералах слоистой структуры содержатся межплоскостные слои). В значительных количествах адсорбционная вода присутствует в твердых коллоидах (опалы и др.). Вода, заполняющая тонкие канальцы в почве, породе, называется гигроскопической (капиллярной). Различают свободную воду, заполняющую пустоты, трещины и перемещающуюся под действием силы тяжести, нагрева батолитов, механической и радиационной химии кимберлитов и др.
Огромные количества воды (13-15 млрд. км3) сосредоточены в мантии Земли (выброс через магматические кальдеры). Вода, выделявшаяся из мантии в процессе внутреннего разогревания Земли на ранних стадиях ее развития, по современным воззрениям, сформировала гидросферу. Ежегодное поступление воды из мантии и магматических очагов составляет около 1 км3 (Ювенильные воды). Имеются данные о том, что вода, хотя бы частично, имеет космическое происхождение (выбросы Солнца, планет, сверхновых и квазаров): протоны, пришедшие в верхнюю атмосферу от Солнца и других звезд, захватив электроны, превращаются в атомы водорода, которые, соединяясь с атомами кислорода, дают воду. Все воды Земли постоянно взаимодействуют между собой, а также с атмосферой, литосферой и биосферой. Вода - активный фактор эндогенных и экзогенных геологических процессов, с водой тесно связаны процессы формирования месторождений и минералообразование.
В природных условиях количественный состав примесей меняется в зависимости от происхождения воды и геологических условий. При концентрации солей до 1 г/кг воду считают пресной, до 25 г/кг - солоноватой, свыше - соленой. Наименее минерализованными водами являются атмосферные осадки (в среднем около 10-20 мг/кг), затем пресные озера и реки (50-1000 мг/кг) - хотя соленые есть. В г. Харьков, Украина, СНГ был летний соленый дождь - 2010 г. (водяные торнадо). Соленость океана колеблется около 35 г/кг; многие моря имеют меньшую минерализацию (Черное море - 17-22 г/кг, приток воды р. Дон, Балтийское море - приток воды р. Нева, 8-16 г/кг, Каспийское море - приток воды р. Волка 11-13 г/кг - по типу Водопад Митчелл, комплексный водопадный кимберлит с патерами).
Минерализация подземных вод вблизи поверхности в условиях избыточного увлажнения составляет до 1 г/кг, в засушливых условиях до 100 г/кг; в глубинных артезианских бассейнах минерализация воды колеблется в широких пределах. Максимальные концентрации солей наблюдаются в соляных озерах (до 300 г/кг) и глубокозалегающих подземных водах (до 600 г/кг). В пресных водах преобладают ионы HCO3-, Ca2+ и Mg2+. Содержание в воде ионов Ca2+ и Mg2+ определяет ее жесткость. По мере увеличения общей минерализации растет концентрация ионов SO42-, Cl-, Na+ и К+. В высокоминерализованных водах (г. Миргород, Полтавская обл., Украина, СНГ и др.) преобладают ионы Cl- и Na+, реже Mg2+ и редко Ca2+. Прочие элементы содержатся в очень малых количествах, хотя почти все естественные элементы периодической системы найдены в природных минеральных кимберлитовых водах.
Первоисточниками солей природных вод являются вещества, образующиеся при химическом выветривании изверженных пород (Ca2+, Mg2+, Na+, К+ и др.) и выделяющиеся на протяжении всей истории Земли из ее недр (CO2, SO2, HCl, NH3 и др.). От разнообразия состава этих веществ и условий, в которых происходило их взаимодействие с водой, зависит состав воды, на изучении которого основаны гидрогеохимические поиски месторождений полезных ископаемых. Большое значение для состава воды имеет и воздействие живых организмов.
Из растворенных газов в природных водах присутствуют азот, кислород, двуокись углерода, инертные газы, сероводород и углеводороды. Газонасыщенность подземных вод изменяется от n * 10 до n * 103 см3/л. Количество растворенного газа прямо пропорционально давлению газа или парциальному давлению в смеси газов. При температуре до 100oС наблюдается обратная зависимость растворимости газов в воде, при температуре выше 100oС прямая. Газонасыщенность воды зависит также от величины минерализации, увеличение которой снижает растворимость газов. Наиболее распространенными газами, растворенными в подземных водах, являются CO2, N2, CH4. Реже и в меньших количествах растворены О2, Н2S, Н2, тяжелые углеводороды, инертные газы и др. Наблюдается зональное распределение газов в подземной гидросфере по вертикали (сверху вниз): О2 N2 N2 Н2S - CO2 - CH4 - N2 CH4 - N2 (или N2 - CH4) CH4 - CO2 - CH4 Н2S - CO2 - CH4 (в порядке преобладания).
Концентрация органических веществ невелика - в среднем в реках около 20 мг/л, в океане около 4 мг/л. Исключение составляют воды болотных и нефтяных месторождений и воды, загрязненные промышленными и бытовыми стоками, где количество их бывает выше. Качественный состав органических веществ чрезвычайно разнообразен и включает различные продукты жизнедеятельности организмов, населяющих воду, и соединения, образующиеся при распаде из их остатков.
При исследованиях закономерностей формирования и распространения природных вод, оценке возможностей их использования (в питьевых, хозяйственно-технических, промышленных, ирригационных, бальнеологических и др. целях), гидрогеохимических поисках месторождений (нефти, газа, полиметаллов, Br, I, В и т.д.) проводят их анализ. В водах определяют: физические и органолептические свойства (температуру, цвет, вкус, запах, мутность, прозрачность, плотность, электропроводность); содержание растворенных минеральных, органических, радиоактивных веществ, свободных газов; различные показатели (pH, Eh, жесткость, окисляемость, агрессивность и др.); изотопный и микробиологический состав. Вид и методы анализов определяются целью исследований и требуемой точностью. При гидрогеохимических поисках руд определяют микрокомпоненты (Cu, Pb, Sn, Ag, Mo, Be, Rb, Cs, Mn, Zn и др.); при поисках и исследованиях нефти - органические вещества (кислоты, ароматические углеводороды, фенолы и др.), газы, индикаторную микрофлору; при изучении минеральных вод - специфические компоненты (As, Br, I, Fe, органические вещества и др.), газовый состав (CO2, Н2S, Н2, О2, Rn, N2, CH4); при исследованиях для водоснабжения, санитарного контроля воды - загрязняющие и токсические (Pb, As, Se, Sr и др.) вещества, бактериологические показатели; при оценке технической свойств воды - обесцвечиваемость, коагулируемость, коррозийные свойства, фильтруемость.
Воду анализируют методами аналитической химии: титриметрическими и инструментальными (колориметрия, фотометрия пламени, фотоколориметрия, спектрофотометрия, потенциометрия, радиометрия, хроматография и др.). Бактериологические анализы выполняют методами прямого счета на мембранных фильтрах и др. Для обеспечения максимальной сохранности состава воды при анализах разработаны правила отбора, предварительной обработки и консервации (подкисление, хлороформирование, охлаждение и др.) проб. Лимитируются сроки хранения проб воды до анализа. Для анализа воды с малым содержанием компонентов применяют концентрирование, экстракцию и др.
Применение воды. Невозможно указать другое вещество, которое бы находило столь разнообразное и широкое применение. Вода - химический реагент, участвующий в производстве кислорода, водорода, щелочей, кислот, спиртов, альдегидов, гашеной извести и др. Вода используется как технологический компонент для варки, растворения, разбавления, выщелачивания, кристаллизации и т.д. Воду применяют в многочисленных производственных процессах. В технике вода служит энергоносителем (гидроэнергетика), теплоносителем (нагревание, охлаждение), рабочим телом (паровые машины). Природные воды употребляют для питьевого и хозяйственного водоснабжения, теплоснабжения (Термальные воды), в бальнеологии (Минеральные воды), для извлечения из них ценных компонентов (Рассолы) и т.п. При производстве горных работ воду используют для транспортирования горных пород и полезных ископаемых в шахтах и карьерах (Гидравлический транспорт), для передачи давления и мощности при бурении забойными двигателями, а также для промывки скважин и др. При разработке обводненных месторождений полезных ископаемых комплексно решаются вопросы водозащиты горных выработок, водопонижения, водоотлива, барража, дренажа, защиты оборудования от действия агрессивных вод и использования воды (например, для гидравлического разрушения горных пород, гидравлической закладки выработанного пространства, пылеподавления, заиливания, противопожарных мероприятий, заводнения месторождений нефти). С применением воды проводятся обогащение полезных ископаемых, их сортировка и т.п.
Изменение свойств воды (магнитная обработка - удаление магнитами феррометаллических, полуорганических, органических и иных реагирующих на магнитное поле примесей) используется для улучшения процессов флотации, очистки воды от взвесей многих типов и др. В результате промышленного использования воды возникает необходимость введения водооборотных систем, бессточных технологий и очистки воды. При сбрасывании сточных вод в природные водоемы очистка производится до норм предельно допустимых концентраций растворенных веществ и проводятся мероприятия по охране гидросферы, охране подземных вод (см. Очистка вод). В СНГ потребление водных ресурсов регламентируется Основами водного законодательства СНГ и государств содружества. Существуют также международные соглашения по охране водных ресурсов в рамках СЭВ и других межправительственных организаций. По материалам: http://www.mining-enc.ru
