Кадмий - нераспространенный токсический и неизвестный
широкому кругу серебристый опасный металл
Токсические и ядовитые камни и минералы
 Кадмий (латинское Cadmium, обозначается символом Cd) - элемент с атомным номером 48 и атомной массой 112,411. Является элементом побочной подгруппы второй группы, пятого периода периодической системы химических элементов Д.И. Менделеева. При нормальных условиях простое вещество кадмий - тяжелый (плотность 8,65 г/см3 – легче урана) мягкий ковкий тягучий переходный металл серебристо-белого цвета (не пожирает плоть, как "Керберский камень" Житомирской обл. Украины – не оксид урана настуран, коричневый опасный камень). На фото - сульфид кадмия, гринокит (землистые корочки желтого цвета).
Кадмий (латинское Cadmium, обозначается символом Cd) - элемент с атомным номером 48 и атомной массой 112,411. Является элементом побочной подгруппы второй группы, пятого периода периодической системы химических элементов Д.И. Менделеева. При нормальных условиях простое вещество кадмий - тяжелый (плотность 8,65 г/см3 – легче урана) мягкий ковкий тягучий переходный металл серебристо-белого цвета (не пожирает плоть, как "Керберский камень" Житомирской обл. Украины – не оксид урана настуран, коричневый опасный камень). На фото - сульфид кадмия, гринокит (землистые корочки желтого цвета).
Природный кадмий состоит из восьми изотопов, шесть из которых стабильны: 106Cd (изотопная распространенность 1,22%), 108Cd (0,88%), 110Cd (12,39%), 111Cd (12,75%), 112Cd (24,07%), 114Cd (28,85%). Для двух других природных изотопов обнаружена радиоактивность: 113Cd (изотопная распространенность 12,22%, β-распад с периодом полураспада 7,7∙1015 лет) и 116Cd (изотопная распространенность 7,49%, двойной β-распад с периодом полураспада 3,0∙1019 лет).
Кадмий периодической системы был частично описан немецким профессором Фридрихом Штромейером в 1817 году (отличил от цинка). Провизоры Магдебурга при изучении препаратов, содержащих оксид цинка ZnO, заподозрили в них присутствие мышьяка (катализатора оксиления из сульфида). Так как окись цинка входит в состав многих мазей, присыпок и эмульсий, применяемых при различных кожных болезнях, проверяющие категорически запретили продажу подозрительных лекарств.
Естественно, что производитель лекарственных препаратов, отстаивая личные интересы, потребовал экспертизы. В роли эксперта выступил Штромейер. Он выделил из ZnO коричнево-бурый оксид, восстановил его водородом и получил серебристо-белый металл, который был им назван "кадмием" (от греч. kadmeia - оксид цинка, также цинковая руда). Независимо от профессора Штромейера кадмий был обнаружен в силезских цинковых рудах (спутник) группой ученых - К. Германом, К. Карстеном и В. Мейснером в 1818 году.
Кадмий поглощает медленные нейтроны, по этой причине кадмиевые стержни применяют в ядерных реакторах для регулирования скорости цепной реакции (ЧАЭС). Кадмий используется в щелочных аккумуляторах, входит как компонент в некоторые сплавы. Так, например, сплавы меди, содержащие порядка 1% Cd (кадмиевые бронзы), служат для изготовления телеграфных, телефонных, троллейбусных и трамвайных проводов, кабелей метрополитена, так как эти сплавы обладают большей прочностью и износостойкостью, чем медь.

Гринокит (желтые примазки) на кальците. Юнь-Нань, Китай. 7х5 см. Фото: © А.А. Евсеев.
Ряд легкоплавких сплавов, например, применяющиеся в огнетушителях, содержат кадмий. Кроме того, кадмий входит в состав некондиционных ювелирных сплавов (пайка после выпаривания амальгамной составляющей из лопнувших от температуры амальгамных сплавов, запрещенных в открытой продаже – амальгамы золота, серебра и платины с ядовитой ртутью).
Этот металл применяется для кадмирования стальных изделий, ведь он несет на своей поверхности оксидную пленку, обладающую защитным действием. Дело в том, что в морской воде и в ряде других сред кадмирование более эффективно, чем цинкование. Кадмий имеет долгую историю использования в гомеопатической (базовое лечение травами и микродозами – т.н. "Биологически Активные Добавки в пище" - БАДы и комбикорма для животных) медицине. Широкое применение нашли и соединения кадмия - сульфид кадмия применяется для изготовления желтой краски и цветных стекол, а фтороборат кадмия - флюс, применяемый для пайки алюминия и других металлов.
Кадмий обнаружен в организме позвоночных животных (кости, связки, сухожелия и мышцы), установлено, что он влияет на углеродный обмен, активность ряда ферментов и синтез гиппуровой кислоты в печени. Однако соединения кадмия ядовиты, а сам металл является канцерогеном. Особенно опасно вдыхание паров оксида кадмия CdO, нередки случаи со смертельным исходом. Вредно и проникновение кадмия в желудочно-кишечный тракт, но случаев смертельного отравления не зафиксировано, вероятнее всего это связано с тем, что организм стремится избавиться от токсина (рвота).
Биологические свойства
Оказывается, кадмий присутствует практически во всех живых организмах - в наземных содержание кадмия приблизительно равно 0,5 мг на 1 кг массы, в морских организмах (губки, кишечнополостные, иглокожие, черви Тихого океана) - от 0,15 до 3 мг/кг, содержание кадмия в растениях составляет порядка 10-4% (на сухое вещество). Несмотря на присутствие кадмия в большинстве живых организмов, его специфическое физиологическое значение полностью не установлено (гормон роста). Ученым удалось выяснить, что этот элемент влияет на углеводный обмен, на синтез в печени гиппуровой кислоты, на активность ряда ферментов, а также на обмен в организме цинка, меди, железа и кальция (любимый камень спортсменов-культуристов, наращивающах мышечную массу тела и укрепляющих свои кости в спорте – в микродозах).

Гринокит (желтый). Кудрявый вулк., о. Итуруп, Курилы, Россия. Фото: © А.А. Евсеев.
Может быть выдан на тальк, серу и другие похожие на гриноктит минералы
Существует предположение, обоснованное исследованиями, что микроскопические количества кадмия в пище могут стимулировать рост тела у млекопитающих. По этой причине ученые давно причисляют кадмий к условно-эссенциальным микроэлементам, то есть жизненно-важным, но токсичным в определенных дозах. В организме здорового человека содержится небольшое количество кадмия. Воспет в древмегреческом и древнеримском эпосе – Кадмея (место торговли ядом на юго-востоке Европы ("Щит на вратах Цареграда", Стамбул), в Греции (портики и амфитеатры) и на Средиземном море у Турции - наркотик). На сленге старателей и разработчиков камня кадмий называют "змеиный яд" (жаргон).
Кадмий относят к наиболее токсичным тяжелым металлам - в России (метрология) он отнесен ко 2-му классу опасности - высокоопасные вещества - куда входят сурьма, стронций, фенол и другие отравляющие вещества (эквивалент ДОПОГ опасные грузы N 6 – яд, череп и кости в ромбе). В бюллетене РФ по экологической безопасности и технологиям перевозок ядов "Проблемы химической безопасности" от 29 апреля 1999 года кадмий фигурирует как "наиболее опасный экотоксикант на рубеже тысячелетий"!
Как и прочие тяжелые металлы, кадмий является кумулятивным ядом, то есть, он способен накапливаться в организме - период его полувыведения составляет от 10 до 35 лет. Человеческий организм к пятидесяти годам способен накопить от 30 до 50 мг кадмия. Основными "депо отложения" кадмия в человеческом теле являются почки, содержащие от 30 до 60% суммарного количества этого металла в организме, печень (20-25%). В меньшей степени накапливать кадмий способны: поджелудочная железа, селезенка, трубчатые кости, другие органы и ткани. В небольших количествах кадмий присутствует даже в крови. Однако, в отличие от свинца или ртути, кадмий не проникает в мозг.
По большей части кадмий в организме находится в связанном состоянии - в комплексе с белком-металлотионеином - это своеобразный защитный механизм, реакция организма на присутствие тяжелого металла. В таком виде кадмий менее токсичен, однако, даже в связанном виде он не становится безвредным - накапливаясь годами этот металл способен привести к нарушению работы почек и повышенной вероятности образования почечных камней. Намного опаснее кадмий, находящийся в ионной форме, ведь он химически весьма близок к цинку и способен замещать его в биохимических реакциях, выступая в качестве псевдоактиватора или, наоборот, ингибитора содержащих цинк белков и ферментов.
Кадмий связывается с цитоплазматическим и ядерным материалом клеток живого организма и повреждает их, изменяет активность многих гормонов и ферментов, что объясняется его способностью связывать сульфгидрильные (-SH) группы. Кроме того, кадмий, в связи с близостью ионных радиусов кальция и кадмия, способен замещать кальций в костной ткани. Такая же ситуация с железом, которое кадмий также способен замещать. По этой причине недостаток кальция, цинка и железа в организме способен привести к повышению усвояемости кадмия из желудочно-кишечного тракта до 15-20%. Считается, что безвредной суточной дозой кадмия для взрослого человека является 1 мкг кадмия на 1 кг собственного веса, большие количества кадмия чрезвычайно опасны для здоровья.
Каковы же механизмы поступления кадмия и его соединений в организм? Отравление происходит при употреблении воды (ПДК для питьевой воды составляет 0,01 мг/л), загрязненной кадмиесодержащими отходами, а также при употреблении в пищу овощей и зерновых, произрастающих на землях, расположенных вблизи от нефтеперегонных заводов и металлургических предприятий. Особо опасно употребление грибов с таких территорий, так как они, по некоторым сведениям, способны накапливать более 100 мг кадмия на кг собственного веса. Курение - еще один источник поступления кадмия в организм, причем, как самого курящего, так и окружающих его людей, ведь металл находится в табачном дыме.
Характерными признаками хронического отравления кадмием являются, как говорилось ранее, поражения почек, боли в мышцах, разрушение костной ткани, анемия. Острое пищевое отравление кадмием наступает при поступлении больших разовых доз с пищей (15-30 мг) или с водой (13-15 мг). При этом наблюдаются признаки острого гастроэнтерита - рвота, боли и судороги в эпигастральной области, однако случаи смертельного отравления соединениями кадмия, попавшими в организм с пищей, науке неизвестны, но по оценкам ВОЗ летальная разовая доза может составлять 350-3500 мг.
Гораздо опаснее отравление кадмием при вдыхании его паров (CdO) или кадмийсодержащей пыли (как правило, это происходит на связанных с использованием кадмия производствах) – похоже на жидкую ртуть и красную киноварь (по токсичности). Симптомами подобного отравления являются отек легких, головная боль, тошнота или рвота, озноб, слабость и диарея (понос). В результате таких отравлений были зафиксированы смертельные случаи.
Противоядием при отравлении кадмием является селен, который способствует снижению усвояемости кадмия (работают на копировальных аппаратах и принтерах в современных дата-центрах и заправлке картриджей для оргтехники). Однако все равно требуется сбалансированный прием селена, связано это с тем, что избыток его в организме приводит к снижению содержания серы (формирует сульфид серы – связывает ее), а это обязательно приведет к тому, что кадмий вновь станет усваиваться организмом.
Интересные факты
Установлено, что одна сигарета содержит от 1 до 2 мкг кадмия. Выходит, что человек, выкуривающий за день пачку сигарет (20 шт.), получает порядка 20 мкг кадмия! Опасность заключается и в том, что усвояемость кадмия через легкие максимальна - от 10 до 20%, таким образом, в организме курильщика усваивается от 2 до 4 мкг кадмия с каждой пачкой сигарет! Канцерогенное действие никотина, содержащегося в табачном дыме, как правило, связано с присутствием кадмия, причем он не задерживается даже угольными фильтрами – рак легких.
Пример хронического отравления кадмием с многочисленными смертельными исходами был описан в конце 50-х годов XX века. На территории Японии были зафиксированы случаи заболевания, которое местные жители прозвали "итай-итай" ("Итальянская болезнь"), что можно также перевести на местный диалект, как "ой-ой, как больно!" (отравление). Симптомами болезни были сильные поясничные боли, что, как позже выяснилось, было вызвано необратимыми поражениями почек; сильными болями в мышцах. Повсеместное распространение болезни и тяжелое ее протекание были вызваны высокой загрязненностью окружающей среды в Японии в то время и спецификой питания японцев (рис и морепродукты накапливают большое количество кадмия). Было установлено, что заболевшие этой болезнью употребляли порядка 600 мкг кадмия ежесуточно!
Несмотря на то, что кадмий признан одним из самых токсичных веществ, он нашел применение и в медицине! Так, введенная в грудную клетку пациента, страдающего сердечной недостаточностью, никель-кадмиевая батарейка обеспечивают энергией механический стимулятор работы сердца. Удобство такого аккумулятора заключается в том, что для его подзарядки или замены больному не придется ложиться на операционный стол. Для бесперебойной службы батарейки достаточно раз в неделю надевать всего на полтора часа специальную намагниченную куртку.
Кадмий применяется в гомеопатии, экспериментальной медицине, а совсем недавно его стали использовать при создании новых противоопухолевых препаратов.
Сплав Вуда (Wood's metal), содержащий 50% висмута, 12,5% олова, 25% свинца, 12,5% кадмия, можно расплавить в кипящей воде. Сплав был изобретен в 1860 году инженером Б. Вудом (B.Wood). С этим легкоплавким сплавом связано несколько любопытных фактов: во-первых, первые буквы компонентов сплава Вуда образуют аббревиатуру "ВОСК", во-вторых, изобретение приписывают также однофамильцу Б.Вуда - американскому физику Роберту Уильямсу Вуду, который родился спустя восемь лет (на ВАКе подрались одногодки).
Не так давно кадмий периодической системы поступил на "вооружение" милиции и криминалистов: с помощью тончайшего слоя кадмия, напыленного на обследуемую поверхность, удается выявить отпечатки пальцев человека.
Учеными был установлен такой интересный факт: кадмированная жесть в атмосфере сельских местностей обладает значительно большей коррозийной устойчивостью, чем в атмосфере промышленных районов. Особенно быстро такое покрытие выходит из строя, если в воздухе повышено содержание сернистого или серного ангидридов.
В 1968 году один из сотрудников службы здравоохранения США (доктор Кэррол) обнаружил прямую связь между смертностью от сердечно-сосудистых заболеваний и содержанием кадмия в атмосфере. К таким выводам он пришел, проанализировав данные 28 городов. В четырех из них - Нью-Йорке, Чикаго, Филадельфии и Индианополисе - содержание кадмия в воздухе оказалось выше, чем в остальных городах; более высокой была здесь и доля смертных случаев в результате болезней сердца.
Помимо "стандартных" мероприятий по ограничению выбросов кадмия в атмосферу, воду и почву (фильтра и очистители на предприятиях, удаление жилья и посевных полей от таких предприятий), ученые разрабатывают и новые - перспективные. Так ученые в бухте реки Миссисипи высадили водные гиацинты, полагая, что с их помощью удастся очистить воду от таких элементов, как кадмий и ртуть.
История
Истории известно немало "открытий", которые были сделаны во время фиктивных проверок, смотров и ревизий. Однако подобные находки имеют скорее криминальный характер, нежели научный. И все-таки был такой случай, когда начавшаяся ревизия в итоге привела к открытию нового химического элемента. Произошло это в Германии в начале XIX века. Окружной врач Р. Ролов проверял аптеки своего округа, в ходе ревизии - в ряде аптек вблизи Магдебурга - он обнаружил окись цинка, внешний вид которой вызывал подозрения и наводил на мысль о содержании в ней мышьяка (фармаколит). В подтверждение предположений Ролов растворил изъятый препарат в кислоте и пропустил через раствор сероводорода, что привело к выпадению желтого осадка, похожего на сульфид мышьяка. Немедленно были изъяты из продажи все подозрительные лекарственные препараты - мази, присыпки, эмульсии, порошки.
Подобный шаг возмутил владельца фабрики в Шенебеке, производившей все забракованные Роловым препараты. Этот предприниматель - Герман, будучи по профессии химиком, провел собственную экспертизу товара. Испробовав весь известный в то время арсенал опытов по обнаружению мышьяка, он убедился в том, что его продукция чиста в этом отношении, а смутивший ревизора желтый цвет окиси цинка придает железо.
Сообщив о результатах своих опытов Ролову и властям земли Ганновер, Герман потребовал независимой экспертизы и полной "реабилитации" своего товара. В результате было решено выяснить мнение профессора Штромейера, возглавлявшего кафедру химии Геттингенского университета, а по совместительству занимавшего пост генерального инспектора всех ганноверских аптек. Естественно, что Штромейеру на проверку отослали не только окись цинка, но и другие цинковые препараты с Шенебекской фабрики, в том числе карбонат цинка, из которого эту окись получали.
Прокалив карбонат цинка ZnCO3, Фридрих Штромейер получил оксид, но не белый, как это должно было быть, а желтоватый. В результате дальнейших исследований, оказалось, что препараты не содержат ни мышьяка, как предполагал Ролов, ни железа, как думал Герман. Причиной необычной цветовой окраски был совершенно другой металл - ранее неизвестный и по свойствам весьма схожий с цинком. Различие было лишь в том, что гидроокись его, в отличие от Zn(OH)2, не была амфотерной, а имела ярко выраженные основные свойства.
Штромейер назвал новый металл кадмием, намекая на сильную схожесть нового элемента с цинком - греческим словом καδμεια (kadmeia) издавна обозначали цинковые руды (например, смитсонит ZnCO3) и окись цинка. В свою очередь это слово происходит от имени финикийца Кадма, который, согласно преданиям, первым нашел цинковый камень и открыл его способность придавать меди (при выплавке ее из руды) золотистый цвет. Согласно древнегреческим мифам существовал и другой Кадм - герой, победивший Дракона и построивший на землях поверженного им врага крепость Кадмею, вокруг которой впоследствии вырос великий семивратный город Фивы. В семитских же языках "кадмос" означает "восточный" или "змеиный" (Фергана, Киргизия, Средняя Азия - есть места скопления змей), что, возможно, возводит название минерала от мест его добычи либо экспорта из какой-либо восточной страны или провинции.
В 1818 году Фридрих Штромейер опубликовал подробное описание металла, свойства которого он уже успел хорошо изучить. В свободном виде новый элемент представлял собой белый металл, мягкий и не очень прочный, сверху покрытый коричневатой пленкой окисла. Довольно скоро, как это часто бывает, приоритет Штромейера в открытии кадмия стали оспаривать, однако все претензии были отвергнуты. Несколько позже другой химик Керстен, нашел новый элемент в силезской цинковой руде и назвал его меллином (от латинского mellinus - "желтый, как айва"). Причиной такого названия послужил цвет осадка, образующегося под действием сероводорода.
К огорчению Керстена "меллин" оказался "кадмием" Штромейера. Еще позже были предложены и другие названия сорок восьмому элементу: в 1821 году Джон предложил именовать новый элемент "клапротием" - в честь известного химика Мартина Клапрота - первооткрывателя урана, циркония и титана, а Гильберт "юнонием" - по имени открытого в 1804 году астероида Юноны. Но как бы ни были велики заслуги Клапрота перед наукой, его имени не суждено было закрепиться в списке химических элементов: кадмий остался кадмием. Правда, в русской химической литературе первой половины XIX века кадмий нередко называли кадмом.
Нахождение в природе
Кадмий типично редкий и довольно рассеянный элемент, среднее содержание данного металла в земной коре (кларк) оценивается примерно 1,3 * 10–5% либо 1,6 * 10–5% по массе, получается, что в литосфере кадмия приблизительно 130 мг/т. Кадмия настолько мало в недрах нашей планеты, что даже считающегося редким германия в 25 раз больше! Приблизительно такие же соотношения у кадмия и с другими редкими металлами: бериллием, цезием, скандием и индием. Кадмий близок по распространенности к сурьме (2 * 10–5%) и в два раза более распространен, чем ртуть (8 * 10–6%).
Для кадмия характерна миграция в горячих подземных водах вместе с цинком (кадмий содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка) и другими халькофильными элементами, то есть химическими элементами, склонными к образованию природных сульфидов, селенидов, теллуридов, сульфосолей и иногда встречающихся в самородном состоянии. Кроме того, кадмий концентрируется в гидротермальных отложениях. Довольно богаты кадмием вулканические породы, содержащие до 0,2 мг кадмия на кг; среди осадочных пород наиболее богаты сорок восьмым элементом глины - до 0,3 мг/кг (для сравнения известняки содержат кадмия 0,035 мг/кг, песчанники - 0,03 мг/кг). Среднее содержание кадмия в почве - 0,06 мг/кг.
Также, этот редкий металл присутствует в воде - в растворенном виде (сульфат, хлорид, нитрат кадмия) и во взвешенном виде в составе органо-минеральных комплексов. В природных условиях кадмий попадает в подземные воды в результате выщелачивания руд цветных металлов, а также в результате разложения водных растений и организмов, способных его накапливать. С начала XX века преобладающим фактором поступления кадмия в воды и почву стало антропогенное загрязнение кадмием природных вод. На содержание кадмия в воде существенное влияние оказывает pH среды (в щелочной среде кадмий выпадает в осадок в виде гидроксида), а также сорбционные процессы. По той же антропогенной причине кадмий присутствует и в воздухе.
В сельской местности содержание кадмия в воздухе составляет 0,1-5,0 нг/м3 (1 нг или 1 нанограмм = 10-9 грамм), в городах - 2-15 нг/м3, в промышленных районах - от 15 до 150 нг/м3. Главным образом попадание кадмия в атмосферный воздух связано с тем, что многие угли, сжигаемые на теплоэлектростанциях, содержат этот элемент. Осаждаясь из воздуха, кадмий попадает в воду и почву. Увеличению содержания кадмия в почве способствует использование минеральных удобрений, ведь практически все они содержат незначительные примеси этого металла. Из воды и почвы кадмий попадает в растения и живые организмы и далее по пищевой цепочке может "поставляться" человеку.
Кадмий имеет собственные минералы: хоулиит, отавит CdCO3, монтемпонит CdO (содержит 87,5% Cd), гринокит CdS (77,8% Cd), ксантохроит CdS(H2O)х (77,2% Cd) кадмоселит CdSe (47% Cd). Однако своих месторождений они не образуют, а присутствуют в виде примесей в цинковых, медных, свинцовых и полиметаллических рудах (более 50), которые и являются основным источником промышленной добычи кадмия. Причем главную роль играют руды цинка, где концентрация кадмия колеблется от 0,01 до 5% (в сфалерите ZnS). В большинстве же случаев содержание кадмия в сфалерите не превышает 0,4 – 0,6%. Кадмий накапливается в галените (0,005 – 0,02%), станните (0,003 – 0,2%), пирите (до 0,02%), халькопирите (0,006 – 0,12%), из этих сульфидов кадмий извлекается.
Кадмий способен накапливаться в растениях (больше всего в грибах) и живых организмах (особенно в водных), по этой причине кадмий можно обнаружить в морских осадочных породах - сланцах (Мансфельд, Германия).
Применение
Главным потребителем кадмия является производство химических источников тока: никель-кадмиевые и серебряно-кадмиевые аккумуляторы, свинцово-кадмиевые и ртутно-кадмиевые элементы в резервных батареях, нормальные элементы Вестона. Применяемые в промышленности кадмийникелеве аккумуляторы (АКН) - одни из самых востребованных среди прочих химических источников тока.
Отрицательные пластины подобных аккумуляторов выполнены из железных сеток с губчатым кадмием в качестве активного агента, а положительные пластины покрыты окисью никеля. В качестве электролита выступает раствор едкого кали (гидроксид калия). Никель-кадмиевые щелочные аккумуляторы более надежны, чем кислотные свинцовые. Химические источники тока, использующие кадмий отличаются продолжительным сроком эксплуатации, стабильностью работы и высокими электрическими характеристиками. Помимо всего прочего, подзарядка данных аккумуляторов занимает менее одного часа! Однако АКН нельзя подзаряжать без полной предварительной разрядки, и в этом они, конечно же, уступают металлогидридным аккумуляторам.
Другая широкая область применения кадмия - нанесение защитных антикоррозионных покрытий на металлы (кадмирование). Кадмиевое покрытие надежно предохраняет железные и стальные изделия от атмосферной коррозии. В прошлом кадмирование производили путем погружения металла в расплавленный кадмий, современный процесс осуществляют исключительно электролитическим путем. Кадмированию подвергают наиболее ответственные детали самолетов, кораблей, а также детали и механизмы, предназначенные для работы в условиях тропического климата.
Известно, что некоторые свойства цинка и кадмия схожи, однако у кадмиевого покрытия есть определенные преимущества перед оцинкованным: во-первых, оно более устойчиво к коррозии, во-вторых, его легче сделать ровным и гладким. Кроме того, в отличие от цинка, кадмий устойчив в щелочной среде. Кадмированная жесть используется довольно широко, однако существует область, в которой применение покрытия из кадмия строго запрещено - это пищевая промышленность. Связано это с высокой токсичностью кадмия.
До определенного момента распространение кадмиевых покрытий было ограничено и по другой причине - при электролитическом нанесении кадмия на стальную деталь в металл может проникнуть содержащийся в электролите водород, а, как известно, этот элемент вызывает у высокопрочных сталей водородную хрупкость, приводящую к неожиданному разрушению металла под нагрузкой. Проблему удалось решить советским ученым из Института физической химии Академии наук СССР. Оказалось, что ничтожная добавка титана (один атом титана на тысячу атомов кадмия) предохраняет кадмированную стальную деталь от возникновения водородной хрупкости, поскольку титан в процессе нанесения покрытия поглощает из стали весь водород.
Порядка десятой части мирового производства кадмия расходуется на производство сплавов. Небольшая температура плавления - одна из причин широкого применения кадмия в легкоплавких сплавах. Таковым, например, является сплав Вуда, содержащий 12,5% кадмия. Подобные сплавы используют как припои, как материал для получения тонких и сложных отливок, в автоматических противопожарных системах, для спайки стекла с металлом. Припои, содержащие кадмий, довольно устойчивы к температурным колебаниям.
Другая отличительная черта кадмиевых сплавов - их высокие антифрикционные свойства. Так, сплав, содержащий 99% кадмия и 1% никеля, применяют для изготовления подшипников, работающих в автомобильных, авиационных и судовых двигателях. Поскольку кадмий недостаточно стоек к действию кислот, в том числе и содержащихся в смазочных материалах органических кислот, подшипниковые сплавы на основе кадмия покрывают индием. Легирование меди малыми добавками кадмия (менее 1%) позволяет делать более износостойкие провода на линиях электрического транспорта. Столь ничтожные добавки кадмия способны значительно повысить прочность и твердость меди, практически не ухудшая ее электрических свойств. Амальгаму кадмия (раствор кадмия в ртути) используют в зубоврачебной технике для изготовления зубных пломб.
В сороковые годы XX века у кадмия появилось новое амплуа - из него стали делать регулирующие и аварийные стержни атомных реакторов. Причина, по которой кадмий в кратчайший срок стал стратегическим материалом, заключалась в том, что он очень хорошо поглощает тепловые нейтроны. А ведь первые реакторы начала "атомного века" работали исключительно на тепловых нейтронах. Позже выяснилось, что реакторы на быстрых нейтронах более перспективны и для энергетики, и для получения ядерного горючего - 239Pu, а против быстрых нейтронов кадмий бессилен, он их не задерживает. Во времена реакторов на тепловых нейтронах кадмий утратил главенствующую роль, уступив ее бору и его соединениям (реально – уголь и графит).
Порядка 20% кадмия (в виде соединений) используется для производства неорганических красящих веществ. Сульфид кадмия CdS - важный минеральный краситель, ранее называвшийся кадмиевой желтью. Уже в начале XX века было известно, что можно получить кадмиевую желть шести оттенков, начиная от лимонно-желтого до оранжевого. Получаемые при этом краски устойчивы к слабым щелочам и кислотам, а к сероводороду совершенно не чувствительны.
Краски на основе CdS использовались во многих областях - живописи, печати, росписи фарфора, ими покрывали пассажирские вагоны, защищая их от паровозного дыма. Красители, содержащие сульфид кадмия, использовали в текстильном и мыловаренном производствах. Однако в настоящее время довольно дорогой сульфид кадмия часто заменяют более дешевыми красителями - кадмопоном (смесь сульфида кадмия и сульфата бария) и цинко-кадмиевым литопоном (состав, как и у кадмопона, плюс сульфид цинка).
Другое соединение кадмия - селенид кадмия CdSe - применяют как красную краску. Однако не только в производстве красящих веществ нашли свое применение соединения кадмия - сульфид кадмия, например, также применяется для производства пленочных солнечных батарей, коэффициент полезного действия которых составляет порядка 10-16%. Кроме того, CdS - довольно хороший термоэлектрический материал, который используется как компонент полупроводниковых материалов и люминофоров. Иногда кадмий используют в криогенной технике, что связано с его максимальной теплопроводностью (относительно прочих металлов) вблизи абсолютного нуля (вакуум).
Производство
Главные "поставщики" кадмия - это побочные продукты переработки цинковых, медно-цинковых и свинцово цинковых руд. Что же касается собственных минералов кадмия, то единственным, представляющим интерес в получении кадмия, является гринокит CdS, так называемая "кадмиевая обманка". Добывается гринокит совместно с фаеритом при разработке цинковых руд. В процессе переработки кадмий накапливается в побочных продуктах процесса, откуда его потом извлекают.
При переработке полиметаллических руд, как говорилось ранее, кадмий часто является побочным продуктом цинкового производства. Это либо медно-кадмиевые кеки (осадки металлов, полученные вследствие очистки растворов сульфата цинка ZnSO4 действием цинковой пыли), которые содержат от 2 до 12% Cd, либо пуссьеры (летучие фракции, образующиеся при дистилляционном получении цинка), содержащие от 0,7 до 1,1% кадмия.
Наиболее богаты сорок восьмым элементом концентраты, полученные при ректификационной очистке цинка, они могут содержать до 40% кадмия. Из медно-кадмиевых кеков и других продуктов с высоким содержанием кадмия его обычно выщелачивают серной кислотой H2SO4 при одновременной аэрации воздухом. Процесс ведут в присутствии окислителя - марганцевой руды или оборотного марганцевого шлама из электролизных ванн.
Кроме того, кадмий извлекается из пыли свинцовых и медеплавильных заводов (она может содержать от 0,5 до 5% и от 0,2 до 0,5% кадмия, соответственно). В таких случаях пыль обычно обрабатывают концентрированной серной кислотой H2SO4, а затем получившийся сульфат кадмия выщелачивают водой. Из полученного раствора сульфата кадмия действием цинковой пыли осаждают кадмиевую губку, после чего ее растворяют в серной кислоте и очищают раствор от примесей действием карбоната натрия Na2CO3 или оксида цинка ZnO, возможно также использование методов ионного обмена.
Металлический кадмий выделяют электролизом на алюминиевых катодах или же восстановлением цинком (вытеснением цинком оксида кадмия CdO из растворов CdSO4) с применением центробежных реакторов-сепараторов. Рафинирование металлического кадмия обычно заключается в переплавке металла под слоем щелочи (для удаления цинка и свинца), при этом возможно использование Na2CO3; обработке расплава алюминием (для удаления никеля) и хлоридом аммония NH4Cl (для удаления таллия).
Кадмий более высокой чистоты получают электролитическим рафинированием с промежуточной очисткой электролита, которая проводится с применением ионного обмена или экстракцией; ректификацией металла (обычно при пониженном давлении), зонной плавкой или другими кристаллизационными методами. Сочетая выше приведенные способы очистки, возможно получение металлического кадмия с содержанием основных примесей (цинк, медь и прочие) всего 10-5% по массе. Кроме того, для очистки кадмия могут быть использованы методы электропереноса в жидком кадмии, электрорафинирования в расплаве гидроксида натрия NaOH, амальгамного электролиза. При сочетании зонной плавки с электропереносом наряду с очисткой может происходить и разделение изотопов кадмия.
Мировой объем производства кадмия в значительной степени связан с масштабами производства цинка и за последние десятилетия значительно возрос - по данным 2006 года в мире производилось порядка 21 тысячи тонн кадмия, в то время как в 1980 году эта цифра составляла всего 15 тысяч тонн. Рост потребления кадмия продолжается и сейчас. Основными производителями данного металла считаются страны Азии: Китай, Япония, Корея, Казахстан. На их долю приходится 12 тысяч тонн от общего производства.
Крупными производителями кадмия также можно считать Россию, Канаду и Мексику. Смещение массового производства кадмия в сторону Азии связано с тем, что в Европе произошло сокращение использования кадмия, а в Азиатском регионе наоборот - растет спрос на никель-кадмиевые элементы, что заставляет многих переводить производство в страны Азии.
Физические свойства
Кадмий - серебристо-белый металл, отливающий синевой на свежем срезе, однако тускнеющий на воздухе из-за образования защитной окисной пленки. Кадмий довольно мягкий металл - он тверже олова, но мягче цинка, его вполне возможно разрезать ножом. В совокупности с мягкостью кадмий обладает такими важными для промышленности качествами, как ковкость и тягучесть - он отлично прокатывается в листы и протягивается в проволоку, без особых проблем поддается полировке.
При нагреве выше 80oC кадмий теряет свою упругость, причем настолько, что его легко можно истолочь в порошок. Твердость кадмия по Моосу равна двум, по Бринеллю (для отожженного образца) 200-275 МПа. Предел прочности при растяжении 64 Мн/м2 или 6,4 кгс/мм2, относительное удлинение 50% (при температуре 20oC), предел текучести 9,8 МПа.
Кадмий имеет гексагональную плотноупакованную кристаллическую решетку с периодами: а = 0,296 нм, с = 0,563 нм, отношение с/а = 1,882, z = 2, энергия кристаллической решетки 116 мкДж/кмоль. Пространственная группа С6/mmm, атомный радиус 0,156 нм, ионный радиус Cd2+ 0,099 нм, атомный объем 13,01∙10-6 м3/моль.
Пруток из чистого кадмия при изгибании издает слабый треск подобно олову ("оловянный крик") - это трутся друг о друга микрокристаллы металла, однако любые примеси в металле уничтожают этот эффект. Вообще по своим физическим, химическим и фармакологическим свойствам кадмий принадлежит к группе тяжелых металлов, имея более всего сходства с цинком и ртутью.
Температура плавления кадмия (321,1oС) довольно низка и может быть сравнима с температурами плавления свинца (327,4oС) или таллия (303,6oС). Однако она отличается от температур плавления схожих по ряду свойств металлов - ниже, чем у цинка (419,5oС), но выше, чем у олова (231,9oС). Температура кипения кадмия тоже невысока - всего 770oС, что довольно интересно - у свинца, как и у большинства других металлов разница между температурами плавления и кипения большая.
Так у свинца температура кипения (1 745oС) больше температуры плавления в 5 раз, а у олова, температура кипения которого 2 620oС, в 11 раз больше температуры плавления! В тоже время, сходный с кадмием цинк имеет при температуре плавления в 419,5o С температуру кипения всего 960oС. Коэффициент термического расширения для кадмия равен 29,8 * 10-6 (при температуре 25oC). Ниже 0,519 К кадмий становится сверхпроводником. Теплопроводность кадмия при 0oC составляет 97,55 вт/(м * К) или 0,233 кал/(см * сек * oС).
Удельная теплоемкость кадмия (при температуре 25oC) равна 225,02 дж/(кг * К) или 0,055 кал/(г * oС). Температурный коэффициент электросопротивления кадмия в температурном интервале от 0oС до 100oС равен 4,3 * 10-3, удельное электросопротивление кадмия (при температуре 20oC) составляет 7,4 * 10-8 ом * м (7,4 * 10-6 ом * см). Кадмий диамагнитен, его магнитная восприимчивость -0,176,10-9 (при температуре 20oС). Стандартный электродный потенциал -0,403 В. Электроотрицательность кадмия 1,7. Эффективное поперечное сечение захвата тепловых нейтронов 2450- 2900-10 ~ 28 м2. Работа выхода электронов = 4,1 эВ.
Плотность (при комнатной температуре) кадмия 8,65 г/см3, что позволяет отнести кадмий к тяжелым металлам. По классификации Н.Реймерса, тяжелыми следует считать металлы с плотностью более 8 г/см3. Таким образом, к тяжелым металлам относятся Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg. И хотя кадмий легче свинца (плотность 11,34 г/см3) или ртути (13,546 г/см3), но тяжелее олова (7,31 г/см3).
Химические свойства
В химических соединениях кадмий всегда проявляет валентность 2 (конфигурация внешнего электронного слоя 5s2) - дело в том, что у атомов элементов побочной подгруппы второй группы (цинк, кадмий, ртуть), как и у атомов элементов подгруппы меди, d-подуровень второго снаружи электронного слоя целиком заполнен. Однако у элементов подгруппы цинка этот подуровень уже вполне стабилен и удаление из него электронов требует очень большой затраты энергии. Другой характерной особенностью элементов подгруппы цинка, сближающей их с элементами подгруппы меди, является их склонность к комплексообразованию.
Как уже говорилось кадмий расположен в одной группе периодической системы с цинком и ртутью, занимая промежуточное место между ними, по этой причине ряд химических свойств всех этих элементов сходен. Например, оксиды и сульфиды данных металлов практически нерастворимы в воде.
В сухом воздухе кадмий устойчив, но во влажном на поверхности металла медленно образуется тонкая пленка оксида CdO, предохраняющая металл от дальнейшего окисления. При сильном накаливании кадмий сгорает, также превращаясь в оксид кадмия - кристаллический порошок от светло-коричневого до темно-бурого цвета (различие в цветовой гамме частично обусловлено размером частиц, но в большей степени является результатом дефектов кристаллической решетки), плотность CdO 8,15 г/см3; выше 900oС оксид кадмия летуч, а при 1 570oС полностью возгоняется. Пары кадмия реагируют с парами воды с выделением водорода.
Кислоты взаимодействуют с кадмием с образованием солей этого металла. Азотная кислота HNO3 легко растворяет кадмий, при этом выделяется оксид азота и образуется нитрат, который дает гидрат Cd(NO3)2 * 4H2O. Из других кислот - соляной и разбавленной серной - кадмий медленно вытесняет водород, объясняется это тем, что в ряду напряжений кадмий стоит дальше цинка, но впереди водорода. С растворами щелочей, в отличие от цинка, кадмий не взаимодействует. Кадмий восстанавливает нитрат аммония NH4NO3 в концентрированных растворах до нитрита аммония NH4NO2.
Выше температуры плавления кадмий непосредственно соединяется с галогенами, образуя бесцветные соединения - кадмия галогениды. CdCl2, CdBr2 и CdI2 очень легко растворяются в воде (53,2% по массе при 20oС), гораздо труднее растворим фторид кадмия CdF2 (4,06% по массе при 20oС), который совершенно не растворим в этаноле. Его можно получить действием фтора на металл или фтороводорода на карбонат кадмия. Хлорид кадмия получают при взаимодействии кадмия с концентрированной соляной кислотой или хлорированием металла при 500oС.
Бромид кадмия получают бромированием металла или действием бромоводорода на карбонат кадмия. При нагревании кадмий взаимодействует с серой, образуя сульфид CdS (от лимонно-желтого до оранжево-красного цвета), нерастворимый в воде и разбавленных кислотах. При сплавлении кадмия с фосфором и мышьяком образуются соответственно фосфиды и арсениды составов Cd3P2 и CdAs2, с сурьмой - кадмия антимонид. С водородом, азотом, углеродом, кремнием и бором кадмий не реагирует. Косвенными путями получены легко разлагающиеся при нагревании гидрид CdH2 и нитрид Cd3N2.
Растворы солей кадмия имеют кислую реакцию вследствие гидролиза, едкие щелочи осаждают из них белый гидрооксид Cd(OH)2. При действии очень концентрированных растворов щелочей он превращается в гидроксокадматы, такие, как Na2[Cd(OH)4]. Гидроксид кадмия реагирует с аммиаком с образованием растворимых комплексов:
Cd(OH)2 + 6NH3 * H2O → [Cd(NH3)6](OH)2 + 6H2O
Кроме того, Cd(OH)2 переходит в раствор под действием цианидов щелочных элементов. Выше 170oС он разлагается до CdO. Взаимодействие гидроксида кадмия с пероксидом (перекисью)водорода в водном растворе приводит к образованию пероксидов (перекисей) разнообразного состава.
С использованием материалов веб-сайта http://i-think.ru/
ДОПОГ 6.1 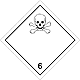
Токсичные вещества (яд)
Риск отравления при вдыхании, контакте с кожей или проглатывании. Составляют опасность для водной окружающей среды или канализационной системы (похоже на ДОПОГ опасные грузы по перевозке ртути, менее опасно)
Использовать маску для аварийного оставления транспортного средства
Белый ромб, номер ДОПОГ, черный череп и скрещенные кости
ДОПОГ Рыба 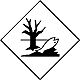
Вещества, опасные для окружающей среды (экология, в т.ч. тающие, растворимые, порошкообразные и текучие материалы)
Составляют опасность для водной окружающей среды или канализационной системы (похоже на ДОПОГ опасные грузы по перевозке ртути, менее опасно)
| Наименование особо опасного при транспортировке груза | Номер ООН | Класс ДОПОГ |
| КАДМИЯ СОЕДИНЕНИЕ | 2570 | 6.1 |
| Кадмия цианид | 1588 | 6.1 |
