Цирконий - редкий и нераспространенный металл
и опаснейший драгоценный камень в оксиде и соли
Токсические и ядовитые камни и минералы
 Цирконий (Zr) - элемент с атомным номером 40 и атомным весом 91,22. Является элементом побочной подгруппы четвертой группы, пятого периода периодической системы химических элементов Д.И. Менделеева. "Генератор" гладиаторских боев в "цирке" - амфитеатре.
Цирконий (Zr) - элемент с атомным номером 40 и атомным весом 91,22. Является элементом побочной подгруппы четвертой группы, пятого периода периодической системы химических элементов Д.И. Менделеева. "Генератор" гладиаторских боев в "цирке" - амфитеатре.
Цирконий в свободном состоянии при нормальных условиях представляет собой блестящий серебристо-белый металл плотностью 6,45 г/см3. Чистый, не содержащий примесей цирконий очень пластичен и с легкостью поддается холодной и горячей обработке. Как и многие другие металлы, включая своего соседа по группе - титан, цирконий, содержащий примеси неметаллов (особенно кислорода – опаснейший совместно с радиацией как примесь к цирконию), резко ухудшает свои механические свойства.
Например, для работы ядерного ускорителя (синхрофазатрона) необходимо, чтобы в расщепляющихся материалах такие "опасные" примеси, как бор, кадмий и другие, содержались в количествах, не превышающих миллионных долей процента. Чистый цирконий - один из лучших конструкционных материалов для атомных реакторов - становится совершенно непригодным для этой цели, если в нем содержится даже незначительная примесь гафния, который не имеет собственных минералов и в природе обычно сопутствует цирконию.
Науке известно пять природных изотопов циркония: 90Zr (51,46%), 91Zr (11,23%), 92Zr (17,11%), 94Zr (17,4%), 96Zr (2,8%). Из искусственно полученных радиоактивных изотопов циркония важнейшим является 95Zr, период полураспада которого 65 суток. Он нашел применение в качестве изотопного индикатора.
Одно из свойств металлического циркония - его высокая стойкость против коррозии в различных средах. Например, он не растворяется в азотной и соляной кислотах и в щелочах. На этом свойстве циркония основано легирование сталей цирконием. Так многокомпонентные магниевые сплавы с добавкой циркония становятся более коррозионно-устойчивыми. Цирконий повышает стойкость титана к действию кислот.
Кроме того, стали, легированные цирконием, не теряют вязкости в широком интервале температур, они хорошо сопротивляются ударным нагрузкам. Повышается прочность легированных сталей. Добавка циркония к меди повышает ее прочность, почти не снижая электропроводность.
Сплав на основе магния с добавкой нескольких процентов цинка и всего нескольких десятых процента циркония вдвое прочнее чистого магния и не теряет прочности при 200oC. Качество алюминиевых сплавов также значительно повышается при добавлении к ним циркония.
Цирконий почти не захватывает медленные (тепловые) нейтроны. Именно на этом его свойстве в сочетании с высокой стойкостью против коррозии и агрессивных сред, механической прочностью при повышенных температурах основано его и сплавов на его основе активное использование в конструировании энергетических атомных реакторов.
При производстве сталей присадки циркония служат для удаления из нее кислорода, азота, серы. Также цирконий используется в качестве легирующего компонента некоторых броневых, нержавеющих и жаропрочных сталей.
На таком известном свойстве циркония, как поглощение газов в нагретом состоянии, основано его применение при спекании порошков металлов, а также в электровакуумной технике. Так при температуре 300oC цирконий поглощает водород, а при 400oC и выше взаимодействует с кислородом и азотом.
Биологические свойства
Напрямую цирконий играет важные биологические роли в жизнедеятельности человеческого организма. Он является биоэлементом, входит в структурный материал клеток - является жизненно важным микроэлементом (это мало кто знает). Это связано со слабой изученностью всех свойств данного металла, ведь постепенно, год за годом, цирконий раскрывает все новые и новые качества, связанные с влиянием этого элемента на организм и здоровье людей.
В настоящее время в клиниках травматологии и челюстно-лицевой хирургии для лечения множественных переломов костей применяется метод фиксаторов (имплантантов), которые фиксируют обломки костей совершенно, исключая сдвиги, что способствует срастанию костных тканей и заживлению послеоперационной раны.
В практике производители имплантантов применяют для изготовления пластин и винтов нержавеющую сталь и титановые сплавы.
Использование медицинских имплантантов из циркониевых сплавов предоставляет ряд преимуществ: высокая коррозионная стойкость материала; отличная биологическая совместимость (отсутствие аллергических реакций и отторжения), благодаря которой, отпала необходимость в повторном хирургическом вмешательстве для извлечения имплантантов; высокие прочностные свойства циркониевых сплавов. Относительно невысокая плотность сплава позволяет облегчить конструкцию имплантанта; пластичность обеспечивает точную подгонку гибом имплантанта по контуру кости.
Перечень инструментов и имплантантов для челюстно-лицевой хирургии и нейрохирургии весьма широк: более двух десятков видов пластин и скоб, кортикальные винты для крепления, кровоостанавливающие зажимы, сверла и нити для наложения швов при операциях мозга!
Цирконий, как и его сплавы, не обладает раздражающим действием на окружающие мягкие ткани и кость, совместим с биологическими тканями, оказывает особое влияние на них. Медики установили, что ношение сережек из циркония заживление ранки мочки уха после прокалывания происходит на 2-3 дня раньше, чем при ношении сережек из золота (амальгамы золота – с ртутью, загнивание уха). Кроме того, люди, носящие бижутерию, изготовленную с применением циркония или цирконов, отмечали некоторое улучшение общего состояния в целом (в т.ч. плацебо).
Опыты дали незначительные положительные результаты при лечении циркониевыми браслетами, поясами и пластинами кожных заболеваний: дерматитах, нейродерматитах, детских экземах, при заболеваниях опорно-двигательного аппарата, отделов позвоночника, артритах и артрозах обменного генеза, переломах верхних и нижних конечностей и других заболеваниях. Положительный эффект наблюдается более чем у 90% пациентов.
Цирконий зарекомендовал себя как прекрасный материал для стоматологических имплантантов, при операциях на мозге, пластин для челюстно-лицевой хирургии.
Как говорилось ранее - не все свойства этого действительно ценного металла раскрыты полностью. Скептическое отношение проявляется к таким изделиям из циркония, как браслеты или пояса, широко разрекламированные. Положительные результаты были получены у больных, страдающих аллергическими дерматитами; нейродермитами; дерматитами, связанными с воздействием вредных и агрессивных веществ; экземами.
У больных псориазом улучшение проявилось у 6% исследуемых. У пациентов страдающих заболеваниями опорно-двигательного аппарата улучшение наступало в 98% случаев! У гипертоников иногда слегка снижалось артериальное давление, уменьшились дозы принимаемых ими медикаментов.
Здоровая половина испытуемых не почувствовала каких-либо отрицательных влияний от ношения браслетов, но отметила улучшение общего состояния здоровья.
Таким образом, можно утверждать, что циркониевые браслеты и прочая бижутерия из этого металла, его сплавов и минералов не является панацеей от всех болезней, однако некоторый оздоровительный эффект на человеческий организм имеет (нужно учитывать радиоактивность).





Интересные факты
 Средневековые ювелиры в королевской Испании использовали при создании украшений в единственном экземпляре (Испания, Запад Европы) так называемые "несовершенные алмазы" (испанский термин, на изображении представитель Испании стоит справа на переговорах с Россией - испанская форма одежды, короткий плащ, облегающие штаны до щиколоток и спрятанные под плащем т.н. испанские "круглые прорезные" штаны, ведутся переговоры о драгоценностях в огранке фасетами Испанской Короны, не ключник) – есть опаснейшие радиоактивные природные цирконы, часто аморфные и с нарушенной кристаллической решеткой, непрозрачные. Время переговоров - 1582 г. (РФ). Внимание !! Сегодня Россия огранила горный хрусталь (XXI в.).
Средневековые ювелиры в королевской Испании использовали при создании украшений в единственном экземпляре (Испания, Запад Европы) так называемые "несовершенные алмазы" (испанский термин, на изображении представитель Испании стоит справа на переговорах с Россией - испанская форма одежды, короткий плащ, облегающие штаны до щиколоток и спрятанные под плащем т.н. испанские "круглые прорезные" штаны, ведутся переговоры о драгоценностях в огранке фасетами Испанской Короны, не ключник) – есть опаснейшие радиоактивные природные цирконы, часто аморфные и с нарушенной кристаллической решеткой, непрозрачные. Время переговоров - 1582 г. (РФ). Внимание !! Сегодня Россия огранила горный хрусталь (XXI в.).
Немногим визуально отличались эти "алмазы" от других драгоценных камней (сильный блеск радиоактивного мутного циркона играет злую шутку с потребителями этих камней) - мягче и может быть мутнее, что не позволяло ограненному камню сиять и переливаться внутри, как алмаз.
Были у этих камней и названия: матарские алмазы – по месту их добычи – местности Матаре (Маттураи) на острове Шри-Ланка. Жаргон или цейлонский жаргон - желтые, соломенно-желтые и дымчатые цирконы. Их также называют сиамскими алмазами.
Старлит или старлайт - циркон с природной или полученной после термохимической обработки небесно-голубой окраской.
Гиацинт - прозрачный медово-желтого, красно-коричневого, красно-бурого, красного, розового цветов циркон. Окраска этого камня напоминает гиацинт - цветок, выращенный, по древнегреческому мифу, Аполлоном из тела (или крови) прекрасного юноши Гиацинта, любимца Аполлона, убитого богом ветра Зефиром. Показанные на гравюре средневековые мастера неграмотные - они не знали, что работают с минералом циркония – монокристаллами циркона (Плиний Старший, "Естественная история").

Иван Грозный показывает сокровища Джерому Горсейю (не Испания). Художник А. Литовченко.
В середине 1560-х гг. Москва (РФ) предпринимала безуспешные попытки наладить поставки краденной поваренной соли (вместо угля для производства ртути) или ворованных цирконов из Мариуполя (розовового цвета) из Украины (Донецкая обл., г. Артемовск, солевые рудники галита, и Мариуполь Азовского побережья Украины) в Испанию, Нидерланды, Швецию, в государства Персидского залива или возобновить торговлю в Англии (кражи чертежей на ВАКе в г. Альмаден, Испания - не криминальные цирконы под запрещенную огранку ювелирами, "камни-убийцы").
Голландские купцы посылали корабли на Кольский полуостров, где нет угля антрацита, поваренной соли галита и тем более ювелирных цирконов. Англичане препятствовали коммерции, вплоть до физической расправы и подкупа властей. По сообщению Симона ван Салингена, такой случай произошел в 1565 г., когда в Печенгской губе были убиты 13 человек, заключивших сделку. Голландцы добивались расследования убийства и посылали представителя в Москву, "но посадник новгородский был подкуплен английской и армянской ("жидовской") компанией и друзьями убийц не пропускать его, чтобы таким образом жалоба на это убийство не дошла до Великого Князя (РФ), и чтобы не возникло бы для англичан какого-либо препятствия их торговле у Св. Николая, начатой за несколько лет перед тем". Все закончилось Архангельско-Северодвинской и Азовской военной операцией Петра I в XVII-XVIII в., расправой с проворовавшимися опальными стрельцами РФ и всевозможными пытками и казнями, прославленными в истории (РФ).
Цирконий имеет малое сечение захвата тепловых нейтронов. Поэтому металлический цирконий, не содержащий гафния, и его сплавы применяются в атомной энергетике для изготовления тепловыделяющих элементов, тепловыделяющих сборок и других конструкций ядерных реакторов. Так на американской атомной подводной лодке "Наутилус" был установлен реактор, полностью изготовленный из циркония. Позже выяснилось, что выгоднее делать из циркония оболочки топливных элементов (ТВЭЛов), а не стационарные детали активной зоны реактора.
Добавки циркония при легировании сталей увеличивают прочностные характеристики сплава. Так образцы сталей, не легированных цирконием разрушаются при нагрузке менее тонны, сталь того же состава, но с добавкой всего 0,1% циркония выдерживает нагрузку выше полутора тонн!
Технические условия на цирконий так называемой "реакторной чистоты" допускают присутствие в нем не больше 0,02% гафния. Но и такие гомеопатические дозы вечного спутника циркония довольно существенно - в шесть с половиной раз - снижают нейтронную прозрачность циркония!
Двуокись циркония обладает интересным свойством: сильно нагретая, она излучает свет настолько интенсивно, что может быть использована в осветительной технике. На основе этого явления сконструировали лампу, в которой стержни накаливания были изготовлены из двуокиси циркония.
Весьма интересное применение нашел тетрахлорид циркония. Электропроводность пластинки из этого вещества меняется в зависимости от давления, которое на нее действует. На этом принципе основана работа универсального манометра - прибора, измеряющего давление. При самом малом изменении давления меняется и сила тока в цепи прибора, шкала которого отградуирована в единицах давления. Такие манометры крайне чувствительны к изменениям давления, поэтому с их помощью можно определять давление от стотысячных долей атмосферы до тысяч атмосфер!
Дождевые плащи обязаны влагоотталкивающим свойствам солям циркония, которые входят в состав особой эмульсии для пропитки тканей. Соли циркония применяют для изготовления цветных (в палитрах CMYK и Pantone) типографских красок, специальных лаков, пластических масс. В качестве катализатора соединения циркония используют при производстве высокооктанового моторного топлива. Сернокислые соединения этого элемента славятся отличными дубильными свойствами.
 Физические особенности природных цирконов.
Физические особенности природных цирконов.
Этот минерал содержит радиоактивные компоненты. С точки зрения физики кристаллов, правильными и безопасными с точки зрения уровня радиации (до 19-24 миллирентген/час) являются природные цирконы небольшого размера, относительно прозрачные, не зеленые и слабо окрашенные - они окрашены незначительным количеством соединений радиоактивных элементов или содержат их в небольших количествах.
Если цирконы окрашены интенсивно, они зеленые, непрозрачные или имеют крупные размеры, высока вероятность того, что это вызывает повышенный естественный уровень радиационного излучения природных цирконов (от 29-32 миллирентген/час и выше) - их категорически запрещается хранить в домашних коллекциях, подвергать серийной и промышленной огранке (особенно в домашних условиях и производственных помещениях, где работает большое количество персонала). Их категорически запрещается облучать и облагораживать в ядерных реакторах и перевозить в больших количествах (суммарно от 29-32 миллирентген/час и выше). Запрещена перевозка радиоактивных камней без знака "радиация" и без дополнительного декларирования на таможне ("радиоактивно").
История
 На самом деле история известности циркония человечеству давняя - еще во времена господства Рима в Иудее (Израиле) первосвященники носили в украшениях гиацинт - кристаллы циркона (радиоактивный от посторонних примесей) - основного минерала циркония.
На самом деле история известности циркония человечеству давняя - еще во времена господства Рима в Иудее (Израиле) первосвященники носили в украшениях гиацинт - кристаллы циркона (радиоактивный от посторонних примесей) - основного минерала циркония.
Этими кристаллами украшали изделия и средневековые ювелиры-убийцы на территории Испании и Западной Европы (убийственный камень судий – особенно зеленый, поражает жертв радиацией, "камень судий") – с целью краж чертежей и научных разработок на ВАКе. Они перекочевали в Россию и далее – в Украину, США и др. страны (интеграция XXI в.). Особую популярность украшения с цирконами приобрели в Индии в XV - XVI веках и в тридцатые годы XIX века (подмена одних личностей другими – женщинами, Тадж Махал).
Добывался минерал циркон, содержащий цирконий, на острове Цейлон, с которого впоследствии заезжие купцы контрабандой вывозили его в изобилии во многие страны (знаменитый "цветочек аленький" для купеческой дочки XVII-XVIII из русских народных сказок – бордовый циркон гиацинт).
Такую популярность кристаллы получили благодаря разнообразной окраске, имитирующей другие камни: от прозрачно-бесцветного (имитатор горного хрусталя) и бледного желто-коричневого (имитатор цитрина), переходящего в серо-зеленый (имитатор демантоида) до кроваво-красного (имитатор рубина и красной испанской Альмаденской киновари, опаснейшего ядовитого наркотического камня Западной Европы). И
менно вишнево-красный (бордовый) циркон ювелиры называли гиацинтом (старинное название - перадоль), считая его одной из разновидностей топаза или рубина, сходных с ним по химическому составу. Лишь в конце XVIII века гиацинт получил свое современное название - циркон Zr(SiO4), которое дал ему минералог Вернер.
Именно один из таких цирконов с Цейлона попал в руки М.Г. Клапрота, который украл сочинения древнего ученого Плиния Старшего на ВАКе (Италия, Везувий). Клапрот украл вещество, которое назвал "цирконовой землей". Это результат сплавления порошка циркона с едкой щелочью в специальном серебряном тигле, затем растворяют сплав в серной кислоте. Далее выделиляют из раствора кремнекислоту и железо, после чего получают кристаллы соли, а из них - окисел ("землю"), названную "циркония" (Zirconerde) – "земля цирка".
Есть и другая трактовка: "zar" ("цар") - золото и "gun" ("гун") - цвет, то есть дословно - "золотисто окрашенный". Другое предположение о происхождения названия отталкивается от арабского слова "zarkun" - киноварь, минерал. Как видите, слова похожи, а это значит, что именно от их значений происходит название металла.
Металлический циркон (с очень большой долей примесей) получил Й.Я. Берцелиус в 1824 году путем восстановления фтор-цирконат калия металлическим натрием:
К2(ZrF6) + 4Na → Zr + 2KF + 2NaF
В результате был получен серебристо-серый металл, который был настолько хрупким, что не поддавался механической обработке (ковке на наковальне в кузне). Причиной всему было большое содержание примесей. Вследствие чего применение данный элемент не получил. Долго ученые разных стран пытались решить проблему чистоты металла. Лишь в 1914 году удалось получить относительно чистый цирконий, а металл, поддающийся обработке (ковке, вальцовке, прокатке) примерно так же, как медь, смогли выделить лишь в 1925 году. Они отошли от традиционного и всеми используемого метода электролиза, воспользовавшись новым методом "наращивания", который заключался в том, что летучее соединение (в их случае это был тетрайодид циркония ZrI4) подвергалось термическому распаду в вакууме, а на раскаленной нити вольфрама оседал чистый металл.
Нахождение в природе
Цирконий – малораспространенный элемент: содержание его в земной коре составляет 0,025% по массе. Среди металлов по распространенности он занимает двенадцатое место. Цирконий сильно распылен и сколько-нибудь значительные скопления его встречаются редко.
Чаще всего его можно встретить в виде химических соединений, которые в свою очередь залегают в литосфере, ведь цирконий - литофильный элемент. В природе известны его соединения с кислородом в виде окислов и силикатов. Несмотря на то, что цирконий, рассеянный элемент, - насчитывается около 40 природных минералов, в которых цирконий присутствует в виде окислов или солей. Из-за такой рассеянности по породам и отсутствия залежей цирконий используется меньше, чем более редкие радиоактивные металлы. Этот металл является слабым водным мигрантом - в морской воде содержание циркония не превышает 0,00005 мг/л. В биологической среде он не распространен.






Минерал циркон. Кристаллы (~2 см) в мариуполите (кристаллический щит Украины).
Октябрьский м-в, Приазовье, юго-восток Украины. Фото © А. Евсеев.
В природе распространены главным образом циркон ZrSiO4, в котором 67,1% ZrO2, бадделеит ZrO2 и различные сложные минералы: эвдиалит (Na,Ca)6ZrOH(Si3O9)2(OH,Cl)2 и др. На фото выше в мариуполите - розовый циркон.
Циркон - самый распространенный циркониевый минерал на Земле, известный с древнейших времен, когда его именовали гиацинт, азорит, ауэрбахит, энгельгардит и другими именами. Циркон является островным силикатом, встречается во всех типах пород, но наиболее характерен для гранитов и сиенитов. Минерал представляет собой хорошо образованные кристаллы, вид которых изменяется в зависимости от условий формирования, так в гранитах и гранитных пегматитах встречаются кристаллы длиннопризматического характера, а в щелочных и метасоматических породах - дипирамидального типа. Так же можно обнаружить "двойников", "коленчатых двойников", радиально-лучистые и сноповидные срастания.
Зачастую кристаллы имеют небольшие размеры (всего несколько миллиметров), но бывают и исключения массой в десятки и даже сотни грамм. На Мадагаскаре нередки находки весом в несколько килограмм. В Соединенных Штатах Америки в Смитсоновском институте хранятся несколько цирконов, привезенных с острова Шри-Ланка. Они различаются по цвету и массе: самый большой циркон – коричневый весит 118,1 карата; желто-коричневый 97,6; желтый 23,5, бесцветный 23,9. Там же можно увидеть большие кристаллы из Бирмы и Тайланда.
Зачастую цирконы содержат множество примесей: железо, алюминий, редкоземельные металлы, гафний, бериллий, уран и прочие. В связи с этим ученые выделяют несколько разновидностей циркона: малакон, цитролит, альвит, аршиновит и многие другие.
Минерал бадделеит, в отличие от циркона, был обнаружен сравнительно недавно - в 1892 году в Бразилии. Там же расположено основное месторождение этого минерала - Посус-ди-Калдас. Некоторые находки этого месторождения просто поражают - одна из глыб бадделеита, извлеченная из породы весила 30 тонн! Вдоль берегов рек и ручьев встречается бадделеит в виде аллювиальной гальки диаметром до 7,5 мм, которая содержит свыше 90% двуокиси циркония. За внешний вид галька была прозвана старателями "фавас", что по-португальски значит "боб" (fava).
Применение
Области применения циркония и содержащих его минералов крайне разнообразны, они связаны с отраслями высоких технологий и в то же время с производством самых обычных потребительских товаров.
Первым потребителем циркония стала металлургия - сначала черная, затем цветная. Это связано с рядом свойств сорокового элемента. Благодаря большому сродству к кислороду, азоту, сере и фосфору сплав циркония с железом и кремнием или с алюминием и кремнием применяют в качестве раскислителя и очистителя стали.
Цирконий используется в качестве легирующего элемента, ведь добавка его к другим металлам придает им особые свойства - жаропрочность, кислотоупорность и многие другие. Кроме вновь приобретенных свойств сплавы с цирконием повышают свою механическую прочность, что способствует увеличению их рабочего ресурса и расширению возможностей использования в различных областях. Стоит привести несколько примеров таких сплавов и области их применения.
Ферроцирконий (сплав циркония с железом), содержащий до 20% Zr, применяется в металлургии как раскислитель и дегазатор для стали. Химики и металлурги выяснили, что добавка циркония к железным сплавам, оказывает такое же влияние, как и введение в них кремния: улучшается качество нержавеющих и жароупорных сталей, повышается механическая прочность и свариваемость сталей.
Еще один сплав циркония, широко применяемый в черной металлургии наряду с ферроцирконием - сплав с кремнием. Этот сплав используют для дегазации сталей, ведь цирконий является энергичным раскислителем и рафинирующей добавкой, его введение быстро восстанавливает металлические окислы и удаляет азот.
Медноциркониевые сплавы используются для изготовления токопроводящих деталей электротехнической аппаратуры, нагревающихся во время работы. Введение циркония практически не влияет на высокую электропроводимость меди, но значительно повышает прочность и термостойкость сплава.
Сплавы магния с цирконием обладают хорошими механическими и физическими свойствами - считаются наиболее пригодными для конструкционных целей.
Сплавы алюминия с цирконием (до 3% Zr) являются коррозионноустойчнвыми, они находят свое применение в сетках катодных электровакуумных ламп.
Наибольшее значение цирконий, очищенный от гафния, приобрел в качестве конструкционного материала в ядерных реакторах. Высокая коррозионная устойчивость в сочетании с механической прочностью, высокой температурой плавления и малым эффективным поперечным сечением поглощения тепловых нейтронов позволили в последнее время широко использовать цирконий для покрытия тепловыделительных элементов (ТВЭЛов).
Низкий и равномерный коэффициент термического расширения, высокая сопротивляемость коррозии, а также высокая механическая прочность и химическая стойкость обусловили применение циркония для изготовления высококачественной химической аппаратуры, медицинского оборудования, имплантантов и нитей для нейрохирургии.
Изоляторы в высокочастотном оборудовании, изготовленные из материалов, содержащих цирконий, значительно снижают потери энергии.
Порошкообразный цирконий используется преимущественно при изготовлении осветительных ракет, детонаторов, снарядных взрывателей и дистанционных бомб.
Но все же большая часть добываемого циркониевого сырья (около 90%) используется в минеральной форме в виде циркона, который содержит до 66% диоксида циркония (ZrO2). Благодаря своим свойствам - высокая температура плавления (более 2700oС), малый коэффициент термического расширения и стойкость к химическим воздействиям - ZrO2 стал применяться в самых разнообразных областях.
Он используется при получении термозащитных покрытий, высокоогнеупорных изделий, твердых электролитов, жаростойких эмалей, тугоплавких стекол, различных видов керамики, керамических пигментов, катализаторов, режущих инструментов и абразивных материалов, искусственных драгоценных камней. С бурным развитием современной электроники и компьютерной техники, а также различных средств связи, диоксид циркония начал применяться в волоконной оптике и производстве керамики, используемой в электронике.
Карбид циркония ZrC ввиду его большой твердости применяют в качестве шлифовального материала, а также для замены алмазов при резке стекла.
Производство
Главным сырьевым источником промышленного производства металлического циркония является минерал циркон ZrSiO4.
Основные методы получения металлического циркония можно разделить на три группы: 1) методы восстановления; 2) методы термической диссоциации и 3) электролитические методы.
Прежде всего, циркониевые руды проходят этап обогащения, для чего применяется гравитационный способ с очисткой концентрата электростатической и магнитной сепарацией. Металлический цирконий производят из его соединений, которые получают разложением концентрата. При этом возможны следующие варианты:
а) спекание с известью или карбонатом кальция с добавлением CaCl2 при температурах свыше 1100oС:
ZrSiO4 + ЗСаО = CaZrO3 + Ca2SiO4
б) спекание с содой при температуре более 1000oС или сплавление с едким натром (температура должна быть выше 500oС):
ZrSiO4 + 2Na2CO3 = Na2ZrO3 + Na2SiO3 + 2CO2
Из сплава или спека (укр. яз. - жара, жар), произведенных щелочным вскрытием, прежде всего, убирают соединения кремния выщелачиванием водой или разбавленной соляной кислотой, после чего остаток разлагают соляной или серной кислотами. В результате получаются оксихлорид и сульфаты соответственно.
в) спекание с фторосиликатом калия при температурах близких к 1000oС:
ZrSiO4 + K2SiF6 = K2ZrF6 + 2SiO2
Получившийся фторцирконатный спек прогревают и омывают подкисленной водой, фторцирконат калия переходит в воду, при охлаждении раствора большая часть (75-90%) его выделяется.
г) хлорирование с углем при температуре около 1000oС, при этом возможна предварительная карбидизация при температуре от 1700 до 1800oС, предназначенная для удаления большей части кремния в виде легколетучего оксида (SiO). В результате получается хлорид циркония ZrCl4, который возгоняется и усиливается.
Из полученных кислых растворов выделяются соединения циркония по следующим методам:
а) гидролитическое осаждение основных сульфатов циркония хZrO2 * ySO3 * zH2O из сернокислых или солянокислых растворов;
б) кристаллизация оксихлорида циркония ZrOCl2 * 8H2O при выпаривании солянокислых растворов;
в) кристаллизация сульфата циркония Zr(SO4)2 при добавлении концентрированной серной кислоты или при выпаривании сернокислых растворов. В результате прокаливания сульфатов и хлоридов получают ZrO2.
Все соединения циркония, полученные из концентратов, содержат гафний. Очищение циркония от него - трудоемкий и дорогостоящий процесс. Цирконий отделяется от постоянного спутника фракционной кристаллизацией K2ZrF6, экстракцией из кислых растворов органических растворителями (например, трибутилфосфатом), ионообменными методами, избирательным восстановлением тетрахлоридов (ZrCl4 и HfCl4).
Существует метод "наращивания", разработанный голландскими учеными ван Аркелем и де Буром. Он заключается в том, что летучее соединение (тетрайодид циркония ZrI4) подвергается термическому распаду в вакууме и на раскаленной нити вольфрама откладывается чистый металл.
В двадцатых годах XX века этот метод был распространен, но высокая стоимость циркония, полученного этим методом, ограничивала области его применения. Поэтому появилась необходимость в разработке нового, более дешевого способа получения циркония. Таким способом стал усовершенствованный метод Кроля. Схема этого производства предусматривает две основные стадии: двуокись циркония хлорируется, а полученный четыреххлористый цирконий восстанавливается металлическим магнием под слоем расплавленного металла. Конечный продукт - циркониевая губка переплавляется в прутки и в таком виде направляется потребителю (на профессиональном жаргоне это назвыется "химический булат").
Физические свойства
В свободном металлическом виде цирконий был выделен в 1824 году шведским химиком Иенсом Берцелиусом. Получить элемент высокой степени чистоты не удавалось в течение долгих десятилетий, именно поэтому изучить физические свойства этого металла не представлялось возможным. Только в середине XX века ученым удалось получить цирконий свободный от примесей. Выяснилось, что в цирконии, порой в очень больших количествах, присутствует гафний - постоянный спутник этого металла, который ранее не был замечен из-за сходных с цирконием химических свойств.
Чистый цирконий имеет облик металла - блестящий серебристо-серый цвет, напоминающий сталь, но отличающийся от нее большей прочностью и пластичностью. Причем последнее качество, как заметили металлурги, напрямую зависит от количества содержащегося в цирконии кислорода. Так, если в расплавленный жидкий цирконий попадает более 0,7% кислорода, то металл будет хрупким из-за образования твердых растворов кислорода в цирконии, свойства которых сильно отличаются от свойств чистого металла. Такое же действие оказывают примеси азота, углерода и водорода. Плотность чистого циркония при 20oC составляет 6,45 г/см3, твердость по Бринеллю 640-670 Мн/м2 или 64-67 кгс/мм2. На твердость большое влияние имеет присутствие примесей (особенно кислорода), которые повышают твердость циркония, снижая его хрупкость. Так при содержании кислорода более 0,2% цирконий не поддается холодной обработке давлением. Предел прочности циркония при растяжении 253 Мн/м2 или 25,3 кгс/мм2, модуль упругости при 20oС = 97 Гн/м2 или 9700 кгс/мм2.
Цирконий - металл высоких температур: температура плавления (tпл) высокочистого циркония 1845oC, температура кипения (tкип) 3580-3700oC. Двуокись же циркония ZrO2 - одно из самых тугоплавких веществ природы. Она плавится при температуре 2680oС! Такие свойства металла и его диоксида обусловили их применение в металлургии: легирование жаропрочных и жаростойких сталей цирконием, использование ZrO2 в изготовлении огнеупоров.
К выше приведенным тепловым характеристикам циркония стоит добавить следующие: удельная теплоемкость в температурном коридоре 25-100oС = 0,291 кДж/(кг∙К) или 0,0693 кал/(г∙oС); коэффициент теплопроводности при 50oС = 20,96 вт/(м∙К) или 0,050 кал/(см∙сек∙oС); температурный коэффициент линейного расширения при температурах 20-400oС = 6,9∙10-6. Температура перехода в состояние сверхпроводимости 0,7К.
Для металлического циркония характерны две аллотропные модификации: α-модификация, имеющая гексагональное строение и устойчивая при температурах ниже 863oC и β-модификация, имеющая решетку пространственно центрированного куба и устойчивая при температуре выше 863oC. Таким образом переход α-модификации в β-модификацию происходит при этой пограничной температуре 863oC. Причем добавки алюминия, свинца, олова и кадмия повышают температуру перехода из одного состояния в другое, а добавки железа, хрома, никеля, молибдена, меди, титана и некоторых других металлов - понижают.
Удельное электрическое сопротивление циркония высокой степени чистоты при температуре 20oС = 44,1 мком∙см. Цирконий парамагнитен, его удельная магнитная восприимчивость увеличивается при нагревании металла. Так при температуре -73oC удельная магнитная восприимчивость циркония равна 1,28oC, а при 327oC - 1,41oC.
Наиболее ценное свойство чистого циркония - малое поперечное сечение захвата тепловых нейтронов (0,18 барна). Оно намного меньше, чем у других металлов - железо (2,53 барна), никель (4,60 барна) или медь (3,69 барна). Хотя многие более дешевые металлы имеют сечение захвата такого же порядка: у олова 0,65 барна, у алюминия – 0,22 барна, а у магния и того меньше – всего 0,06 барна. Однако все перечисленные металлы легкоплавки и нежаропрочны в отличие от циркония. Поэтому этот металл используется как конструкционный при строительстве реакторов.
Химические свойства
Одно из самых замечательных свойств циркония - это его высокая коррозионная стойкость по отношению ко многим агрессивным средам. По способности сопротивляться коррозии цирконий превосходит такие стойкие металлы, как ниобий и титан. При обычных условиях цирконий инертен по отношению к атмосферным газам и воде, не реагирует с соляной и серной (концентрацией до 50%) кислотами. При проведении опытов было установлено, что нержавеющая сталь теряет в пятипроцентной соляной кислоте при 60oС примерно 2,6 миллиметра в год, титан - около 1 миллиметра, а цирконий - в 1000 раз меньше. Самое большое сопротивление цирконий оказывает щелочам, это единственный металл стойкий в щелочах, содержащих аммиак. По сопротивлению агрессивным средам цирконию уступает даже тантал - один из самых мощнейших борцов с коррозией.
Такая сопротивляемость объясняется химическими свойствами циркония, а точнее образованием защитной оксидной пленки на его поверхности, которая предохраняет металл от дальнейшего разрушения. Чтобы полностью окислить цирконий придется нагреть его до 700oC, только тогда пленка частично разрушится, частично растворится в металле. Получается, что температура в 700oC - граница, за которой заканчивается химическая стойкость элемента под номером 40. Но и до этой границы цирконий при нагреве уже до 300oC и выше начинает активнее реагировать с кислородом и прочими составляющими атмосферы. В итоге, образуя с водяными парами двуокись и гидрид, с углекислым газом - карбид и двуокись, с азотом - нитрид циркония. До этой же температуры цирконий надежно защищен окисной пленкой, которая гарантирует высокую химическую стойкость циркония.
И все же цирконий взаимодействует с кислотами, это происходит, если возможно образование анионных комплексов. Так при температуре выше 100oC он взаимодействует со смесью азотной и плавиковой кислот и царской водкой:
3Zr + 4HNO3 + 18HF = 3H2(ZrF6) + 4NO + 8H2O
3Zr + 4HNO3 + 18HCl = 3H2(ZrCl6) + 4NO + 8H2O
Растворяется в плавиковой и горячей концентрированной (выше 50%) серной кислотах:
Zr + 6HF = H2(ZrF6) + 2H2
Совершенно иначе на воздухе ведет себя цирконий в виде стружки или порошка. В отличие от компактного металлического циркония эти пироморфные вещества легко самовоспламеняются на воздухе уже при комнатных температурах. Такой процесс является экзотермическим и происходит с большим выделением теплоты. Пылевидный цирконий в смеси с воздухом способен взрываться. Это – опасные грузы, транспортируемые по системе ДОПОГ опасные грузы (2004 г.).
Необычно взаимодействие циркония и с водой. Большинство металлов при контакте с водой подвергаются гальванической коррозии, которая заключается в переходе их катионов в воду. Цирконий же, как и при реакции на кислород, взаимодействуя с водой, покрывается защитной пленкой, которая не растворима. Таким образом, благодаря свойствам своей защитной пленки цирконий защищен от водной коррозии.
При нагревании цирконий начинает взаимодействовать с газами. Так при температурах выше 800oC компактный цирконий начинает активно поглощать кислород:
Zr + O2 = ZrO2
С азотом цирконий начинает взаимодействовать при температурах 700-800oC с образованием нитрида: ZrN.
При температуре выше 300oC цирконий начинает поглощать водород, образуя твердый раствор и гидриды ZrH и ZrH2. При 1200-1300oС в вакууме гидриды диссоциируют и весь водород может быть удален из металла.
При нагреве цирконий также начинает реагировать с неметаллами. При температуре выше 900oС происходит взаимодействие с углеродом с образованием карбида ZrC. С хлором, йодом и бромом цирконий реагирует уже при 200oС, образуя высшие галогениды ZrX4 (где X - галоген). С фтором взаимодействие происходит при обычной температуре.
С использованием материалов веб-сайта http://i-Think.ru/
ДОПОГ 1 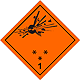
Бомба, которая взрывается
Могут характеризоваться рядом свойств и эффектов, таких как: критической массой; разбросом осколков; интенсивный пожар/тепловой поток; яркая вспышка; громкий шум или дым.
Чувствительность к толчкам и/или ударам и/или теплу
Использовать укрытие, при этом держаться на безопасном расстоянии от окон
Оранжевый знак, изображение бомбы при взрыве
ДОПОГ 4.1 
Легковоспламеняющиеся твердые вещества, самореактивные вещества и твердые десенсибилизированные взрывчатые вещества
Риск пожара. Легковоспламеняющиеся или горючие вещества могут загораться от искр или пламени. Могут содержать самореактивные вещества, способные к экзотермическому разложению в случае нагревания, контакта с другими веществами (такими как: кислоты, соединения тяжелых металлов или амины), трению или удару.
Это может привести к выделению вредных или легковоспламеняющихся газов или пары или самовоспламенения. Емкости могут взрываться при нагревании (сверхопасны - практически не горят).
Риск взрыва десенсибилизированных взрывчатых веществ после потери десенсибилизатора
Семь вертикальных красных полос на белом фоне, равновеликие, номер ДОПОГ, черное пламя
ДОПОГ 4.2 
Вещества, способные к самовоспламенению
Риск пожара в результате самовоспламенения в случае, если упаковки повреждены или произошел исток содержимого.
Могут бурно реагировать с водой
Белая верхняя половина ромба, красная - нижняя, равновеликие, номер ДОПОГ, черное пламя
ДОПОГ 3 

Легковоспламеняющиеся жидкости
Риск пожара. Риск взрыва. Емкости могут взрываться при нагревании (сверхопасны – легко горят)
Использовать укрытие. Избегать низких участков поверхности (ям, низин, траншей)
Красный ромб, номер ДОПОГ, черное или белое пламя
ДОПОГ 5.1 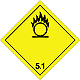
Вещества, которые окисляются
Риск бурной реакции, воспламенения или взрыва при контакте с горючими или легковоспламеняющимися веществами
Не допускать образования смеси груза с легковоспламеняющимися или горючими веществами (например опилками)
Желтый ромб, номер ДОПОГ, черное пламя над кругом
ДОПОГ 7 

Радиоактивные материалы (радиация, Украина)
Риск поглощения внешнего и внутреннего радиационного облучения
Ограничить время влияния, ожоги радиацией, радиационная засветка фото- и киноматериалов
Желтая верхняя половина ромба, белая - нижняя, равновеликие, номер ДОПОГ, черный знак радиации, надпись
ДОПОГ 8 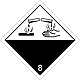
Коррозийные (едкие) вещества
Риск ожогов в результате разъедания кожи. Могут бурно реагировать между собой (компоненты), с водой и другими веществами. Вещество, что разлилось / рассыпалось, может выделять коррозийную пару.
Составляют опасность для водной окружающей среды или канализационной системы
Белая верхняя половина ромба, черная - нижняя, равновеликие, номер ДОПОГ, пробирки, руки
| Наименование особо опасного при транспортировке груза | Номер ООН | Класс ДОПОГ |
| ЦИРКОНИЙ – ПОРОШОК УВЛАЖНЕННЫЙ с массовой долей воды не менее 25% | 1358 | 4.1 |
| ЦИРКОНИЙ – ПОРОШОК Сухой | 2008 | 4.2 |
| ЦИРКОНИЙ СУХОЙ в виде обработанных писем, штаб или змеевиков из провода в бухтах | 2009 | 4.2 |
| ЦИРКОНИЙ СУХОЙ в виде спиралей из провода, обработанных металлических листов, фрольги (тоньше 254 микрон, но не тоньше 18 микрон) | 2858 | 4.1 |
| ЦИРКОНИЙ, СУСПЕНЗИРОВАННЫЙ В ЛЕГКОВОСПЛАМЕНЯЮЩЕЙСЯ ЖИДКОСТИ | 1308 | 3 |
| ЦИРКОНИЙ, СУСПЕНЗИРОВАННЫЙ В ЛЕГКОВОСПЛАМЕНЯЮЩЕЙСЯ ЖИДКОСТИ (давление паров при 50oС более 110 кПа) | 1308 | 3 |
| ЦИРКОНИЙ, СУСПЕНЗИРОВАННЫЙ В ЛЕГКОВОСПЛАМЕНЯЮЩЕЙСЯ ЖИДКОСТИ (давление паров при 50oС не более 110 кПа) | 1308 | 3 |
| ЦИРКОНИЯ Отходы | 1932 | 4.2 |
| ЦИРКОНИЯ Гидрид | 1437 | 4.1 |
| ЦИРКОНИЯ Нитрат | 2728 | 5.1 |
| ЦИРКОНИЯ ПИКРАМАТ УВЛАЖНЕННЫЙ с массовой долей воды не менее 20% | 1517 | 4.1 |
| ЦИРКОНИЯ ПИКРАМАТ сухой или увлажненный с массовой долей воды менее 20% | 0236 | 1 |
| ЦИРКОНИЯ Тетрахлорид | 2503 | 8 |
